ПОТЕНЦІОМЕТРИЧНЕ ВИЗНАЧЕННЯ рН — електрометричний метод визначення активності іонів гідрогену у вигляді водневого показника рН (див. Водневий показник), що базується на вимірюванні різниці потенціалів, які виникають на межі зовнішньої поверхні рН-селективної мембрани скляного електрода і випробовуваним розчином, з одного боку, та внутрішньої сторони мембрани і стандартним розчином кислоти — з іншого (див. Скляний рН-електрод) за умов нульового значення струму в колі.
На практиці П.в. рН здійснюють шляхом вимірювання різниці потенціалів кола з перенесенням іонів, складеного зі скляного рН-електрода, оборотного до активності іонів гідрогену, та хлоридосрібного електрода порівняння, насиченого хлоридом калію:
(–) Ag, AgCl | KCl (нас.) Н+ || скляна мембрана || HCl (0,1 М) | AgCl, Ag (+)
електрод порівняння скляний електрод
Різниця потенціалів скляного та хлоридосрібного електродів кола при 298 К:
Е=φcкл–φAg,AgCl|Cl—=φо–0,059 рН–φAg,AgCl|Cl—.
Оскільки потенціал хлоридосрібного електрода та стандартний потенціал скляного електрода (внутрішній електрод порівняння) величини постійні, можна записати: Е=const–0,059 pH. Вимірювання різниці потенціалів електродної системи здійснюють компенсаційним методом за допомогою іономіра (див. Іономір (рН-метр)), який попередньо градуюють в одиницях рН за стандартними буферними розчинами з точно відомим значенням величини рН. За умов збереження постійного значення дифузійного потенціалу після заміни стандартного буферного розчину досліджуваним розчином значення інструментальної величини рН випробовуваного розчину пов’язане з рН стандартного буферного розчину (рНст) таким рівнянням:
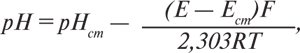
де Е — різниця потенціалів, яку спостерігають, у випробовуваному розчині, у вольтах; Ест — різниця потенціалів такої самої пари електродів у стандартному буферному розчині з відомим значенням рНст, у вольтах; T — абсолютна температура розчину, К; R — універсальна газова стала, дорівнює 8,314 Дж·град–1моль–1; F — число Фарадея, яке дорівнює 96485 Кл моль–1; n — кількість електронів, перенесених під час реакції, в розрахунку на 1 мол. м. еквівалента речовини. П.в. рН точніше за колориметричний, воно дає можливість здійснювати вимірювання показника активності іонів гідрогену з похибкою ±0,02–0,05 рН в інтервалі від 1 до 12 залежно від експлуатаційних характеристик скляного електрода та іономіра (рН-метра). П.в. рН є фармакопейним методом, його застосовують при контролі якості ЛП (див. Потенціометрія), для дослідження процесів у клітинах і тканинах живого організму. П.в. рН має важливе клінічне значення (рН сечі може мати значення при диференційній діагностиці алкалозу та ацидозу різної етіології).
Бейтс Р. Определение рН. Теория и практика. — Л., 1972; Никольский Б.М., Матерова Е.А. Ионоселективные электроды. — Л., 1980.
