ПОРФІРИНИ, Porphyrin, вірогідно, походить від слова порфіра (грец. porphyreos — пурпурний); мають характерне забарвлення. П. — природні макрогетероциклічні пігменти, які містять у молекулі цикл порфіну — тетрапірольну макроциклічну сполуку, в якій чотири залишки піролу почергово з’єднані метиновими групами. Всередині порфіну можуть знаходитись атоми металів: заліза (гемоглобін та деякі ферменти), магнію (хлорофіл і його аналоги), кобальту, цинку. Попередниками в біосинтезі П. є гліцин і бурштинова кислота. П. виявлені у виділеннях тварин, пір’ї птахів, шкаралупі яєць, черепашках молюсків, нафті, бітумах, метеоритах.
Структурна формула порфіну і схема нумерації атомів і кілець:
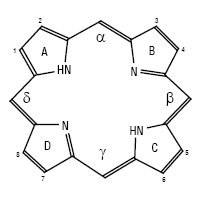
за Х. Фішером
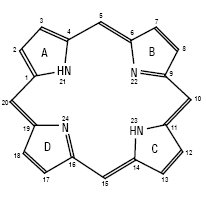
за номенклатурою IUPAC
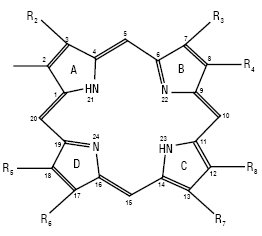
П.
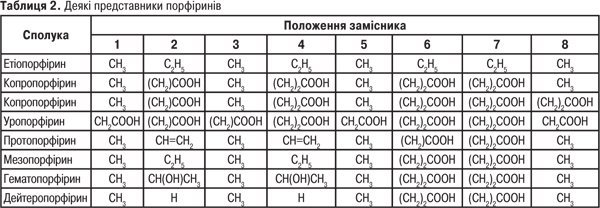
Основні П.:
П. — R1=R2=R3=R4= R5=R6=R7=R8=H;
протопорфірин — R1=R3=R5=R8=CH3 R2= R4=—CH=CH2 R6=R7=C2H4COO H;
уропорфірин — R1=R3=R5=R8=CH2COOH R2=R4=R6=R7=C2H4COOH.
П. здійснюють біологічні, фотохімічні та ферментативні реакції в живих організмах; беруть участь у таких фундаментальних процесах життєдіяльності, як фотосинтез і дихання.
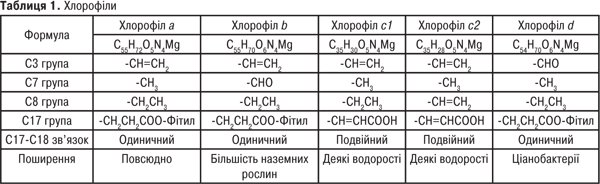
Найважливіші природні П. — хлорофіл та гем крові. Вищі рослини і зелені водорості містять хлорофіли а і b, бурі та діатомові водорості — a і c, червоні водорості — хлорофіли a і d. У фотосинтезувальних бактеріях містяться близькі аналоги хлорофілів — бактеріофіли. Назву «хлорофіл» дали французькі хіміки П. Пельтьє і Ж. Каванту зеленому спиртовому розчину суміші рослинних пігментів (1817). Вперше хлорофіли на а і b розділив на початку ХХ ст. російський учений М.С. Цвєт за допомогою розробленого ним хроматографічного методу. Хімічну природу з’ясували німецькі вчені Р. Вільштеттер, А. Штоль (1913) та Х. Фішер (1930–1940), а повний синтез здійснив американський хімік Р. Вудворд.
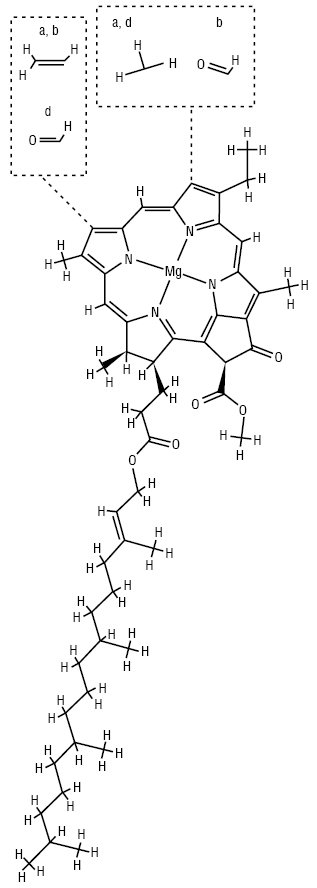
Хлорофіл — структура хлорофілів a, b і d
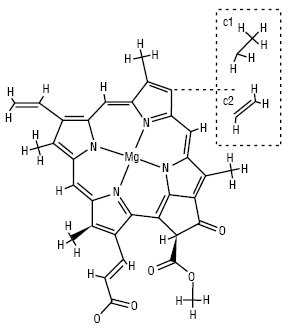
Структура хлорофілу c1 і c2
Хлорофіл у процесі фотосинтезу з неорганічних сполук синтезує органічні сполуки і поповнює запас кисню в атмосфері Землі. У хлорофілах (табл. 1), для яких характерне зелене забарвлення, частково гідровані один або два піроли, молекула має назву хлорин або бактеріохлорин.
Хлорофіли — складні ефіри, добре розчинні у полярних органічних розчинниках (ацетон, спирти). Хлорофіли — лабільні речовини: руйнуються під дією світла, кисню повітря, тепла, кислот та лугів. У розчинах при кімнатній температурі хлорофіли ізомеризуються у епімери, напр., хлорофіли а і b перетворюються на а1 і b1. У присутності кислот з молекули хлорофілу видаляється іон магнію і утворюється феофітин. Обробка концентрованими кислотами приводить до відщеплення від хлорофілів фітолу й утворення феофорбіду, який розчинний у воді. Лужний гідроліз також приводить до утворення феофорбіду, його метилових ефірів та хлорофіліду. За допомогою цих реакцій очищають екстракти гідрофобних речовин від хлорофілу. Обробка хлорофілів сильними окисниками розщеплює їх на мономери похідних піролів.
Гем, який входить до складу гемоглобіну, відповідає за транспортування кисню по кров’яному руслу людини та тварин. Структури типу гему функціонують у теплокровних тварин і людини. У плазунів і молюсків замість заліза як центральний іон може бути кобальт, що приводить до появи крові блакитного забарвлення. Численні ферментні системи, такі як цитохроми, каталаза та пероксидаза, містять комплекси П. з металами. Цитохроми — порфіринові комплекси заліза, які беруть участь в обміні речовин на рівні клітини. У процесі функціонування каталази та пероксидази відбувається розщеплення перекису водню та інших шкідливих для клітини радикалів, тобто ці ферменти захищають живу клітину від руйнування.
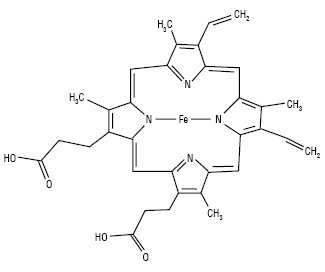
Гем
Порфіринові структури входять до складу таких важливих біологічних молекул, як вітаміни. Найскладнішу структуру порівняно з іншими вітамінами має вітамін B12 (Соa-[a-(5,6-диметилбензимідазоліл)-Соb-кобамідціанід, або a-(5,6диметилбензимідазоліл)-кобамідціанід), основу молекули якого складає коринове кільце. Корин відрізняється від П. тим, що два пірольних цикли в його складі з’єднані між собою безпосередньо, а не метиленовим містком. У центрі коринової структури розміщується іон кобальту. Чотири координаційні зв’язки кобальт утворює з атомами азоту, ще одним координаційним іонним зв’язком з’єднується з диметилбензимідазольним нуклеотидом. Останній, шостий координаційний зв’язок кобальту, залишається вільним, саме за цим зв’язком і приєднується ціаногрупа, гідроксильна група, метильний або 5′-дезоксіаденозильний залишок з утворенням чотирьох варіантів вітаміну B12: ціанокобаламін (продукт, отриманий при хімічному очищенні вітаміну ціанідами), гідроксикобаламін і дві коферменті форми вітаміну B12: метилкобаламін і 5-дезоксіаденозилкобаламін.
Синтез П.: при взаємодії піролу з формальдегідом у лужному середовищі відбувається оксиметилювання за положенням 2, а в кислому середовищі утворюється спочатку оксиметильна похідна, яка реагує ще з однією молекулою піролу — утворюється дипірилметан, який окиснюється залізом хлориду в пірометан (останній може бути отриманий також конденсацією піролу з мурашиною кислотою або з 2-формілпіролом), а потім конденсується у порфін.
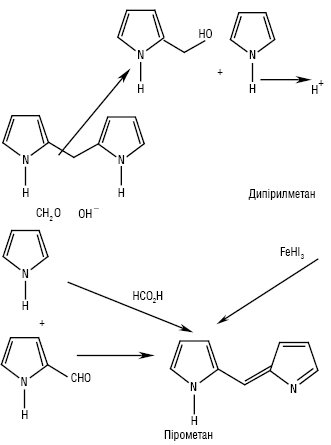
Порфін може утворюватись безпосередньо при взаємодії пірол-2-альдегіду з мурашиною кислотою.
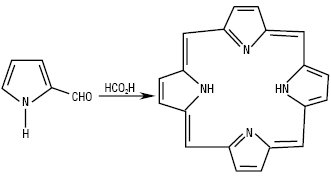
Порфін
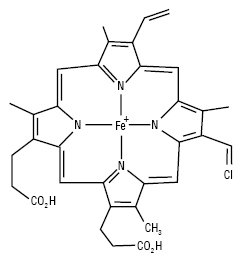
Гемін
Активно вивчається можливість синтезу на основі порфіринових систем нових ефективних замінників крові, термо- та світлостабілізаторів, ЛП, органічних напівпровідників, барвників для бавовни, хімічних волокон та пластмас на їх основі, джерел накопичення енергії сонця та блокаторів розпаду білкових молекул живих організмів під впливом рентгенівського й гамма-випромінювання (табл. 2).
Природні вільні П. — амфоліти (ізоелектрична точка 3,5–4,5) і тому розчинні у мінеральних кислотах і водних лугах, особливо добре у водному аміаку. Як правило, вільні П. добре розчиняються у льодяній оцтовій кислоті, етилацетаті, піридині, циклогексані, ДМФА; у суміші льодяна оцтова кислота — ефір (крім уропорфіринів), концентрованій сірчаній кислоті та концентрованому амоніаку; помірно — у хлороформі, ефірі (крім уропорфіринів); малорозчинні або нерозчинні у спиртах; нерозчинні у воді та петролейному ефірі. Метилові ефіри мають, як правило, більшу розчинність в органічних розчинниках: бензолі, хлороформі; не розчиняються у лугах. Комплекси П. з металами мають знижену розчинність в органічних розчинниках. Fe-П. добре розчинні у піридині, суміші ацетон-хлористоводнева кислота; нерозчинні у мінеральних кислотах. Неіонні детергенти (твін 80), а також аніонні та катіонні детергенти підвищують розчинність у водних середовищах.
П. (метилові ефіри П., металокомплекси П.) добре кристалізуються з бензолу, суміші метанол — хлороформ; полікарбоксильні П. — з гарячого метанолу; П. з карбонілами у бічних ланцюгах — з суміші хлороформ — ефір. Для кристалів П. можливий поліморфізм. Кристали комплексів Ме-ефірів П. з Сu менше піддаються поліморфізму і мають більш чіткі грані площини. Ізомери П. вивчають методом рентгеноструктурного аналізу.
П. виявляють високу фотосенсибілізувальну активність. Спектр поглинання П. може мати два діапазони: 400–410 нм і 580–800 нм. Для спектрів хлорофілів характерна наявність максимуму поглинання при довжині хвилі 400 — 430 нм (так звана смуга Соре). Максимуми поглинання: для хлорофілу а — 662, 516, 578, 534, 430, 410; для хлорофілу b — 644, 595, 549, 455, 430; для бактеріофілу а — 773, 697, 577, 530, 391, 358 та для бактеріофілу b — 794, 676, 578, 408, 368.
Спектр поглинання П., що відповідає за флуоресценцію і забарвлення у видимій частині світла, має максимум у межах 401–405 нм, а також чотири піки поглинання у межах 480–620 нм.
Вивчення природних П. стало підґрунтям для створення синтетичних П., які поряд із природними широко використовуються в різних наукових дослідженнях, у виробництві фарб, напівпровідників та каталізаторів. Синтетичні П. мають низку переваг порівняно з природними, а саме: легший і дешевший спосіб отримання великих кількостей речовини та чітко визначений хімічний склад, що є дуже важливими факторами для наукових досліджень і широкого використання в промисловості та медицині. Порушення порфіринового обміну викликає тяжкі захворювання: анемію, рак, нейропсихічні розлади, порфирії, червоний вовчак.
Дослідження фізико-хімічних та біологічних властивостей П. проводяться у фізико-хімічному інституті ім. А.В. Богатського НАНУ (Одеса), в Інституті органічної хімії НАНУ (Київ), у Московській державній академії тонкої хімічної технології ім. М.В. Ломоносова (МІТХТ), в Інституті органічної та фізичної хімії РАН (Казань), Інституті хімічної фізики РАН (Москва), Університеті м. Афіни (Греція), Центрі спектроскопії університету (м. Гренобль, Франція), в Aberdeen’s Rowett Research Institute (м. Абердин, США), у Технологічному інституті штату Джорджія (США), в Офтальмологічному інституті Уілмера при Університеті Джонса Гопкінса, в Інституті ракових захворювань у Росвел-парку (м. Буффало, США). Основним науковим напрямком кафедри хімії та технології біологічно активних сполук ім. М.О. Преображенського (МІТХТ) є синтез та вивчення супрамолекулярних структур на основі порфіринів, пептидів, вуглецевих сполук і ліпідів для моделювання природних енергопереносних систем і створення нових високоефективних ЛП.
У 1978 р. американський професор Т. Догерті парентерально вводив хворим на рак екзогенний П. і піддавав пухлину опроміненню світлом певної довжини хвилі, яка збуджувала лише П. Внаслідок властивості ракових клітин селективно накопичувати і утримувати П., які під час опромінення виділяють у значній кількості кисень, що руйнує ракові клітини.
З часом цей метод, так звана фотодинамічна терапія раку, отримав розвиток в Італії, Великобританії, Франції, Японії, Росії, Китаї, а з 1992 р. в Україні (див. Фотодинамічна терапія).
Отже П. уже сьогодні можуть бути потенціальними складовими енергопереносних систем для лікування онкозахворювань різної етіології.
Высокоэффективная жидкостная хроматография некоторых замещенных порфиринов / Г.Д. Брыкина, Т.В. Афанаскина, К.В. Успенский и др. // Вестн. Моск. ун-та. — 2002. — Т. 43. — № 1; Порфирины: структура, свойства, синтез / К.А. Аскаров, Б.Д. Березин, Р.П. Евстигнеева и др. — М., 1985; Порфирины: спектроскопия, электрохимия, применение / К.А. Аскаров, Б.Д. Березин, Е.В. Быстрицкая и др. — М., 1987; Тулаева Л.А., Потапов Г.П. Синтез и свойства водорастворимых производных хлорина Е6 // Химия растительного сырья. — 2002. — № 2.