ПОЛЯРОГРАФІЯ — це вольтамперометричний метод аналізу, в якому як мікроелектрод використовується крапельний ртутний електрод. П. як метод аналізу запропонував у 1922 р. чеський електрохімік Я. Гейровський. Метод знайшов широке застосування в хімії. За це відкриття Я. Гейровський одержав Нобелівську премію (1959).
П. з використанням крапельного ртутного електрода одержала назву класичної полярографії. Крапельний ртутний мікроелектрод — скляний капіляр діаметром 0,03–0,05 мм та завд. декілька сантиметрів, з якого витікає ртуть у розчин, що аналізують, зі швидкістю 1–10 крапель на 1 с. Швидкість витікання ртуті регулюється висотою стовпа ртуті, що знаходиться у спеціальному резервуарі, сполученому з капіляром гумовою трубкою. Як макроелектрод у класичній П. використовують шар ртуті на дні полярографічної комірки. Її зазвичай називають донною ртуттю. Ртутний крапельний електрод має низку переваг: високе перенапруження виділення на ньому гідрогену дозволяє працювати в широкій області потенціалів (від +0,3 В до –2,0 В); безперервне відновлення поверхні електрода після відриву краплі; утворення нової краплі ртуті запобігає її забрудненню продуктами електролізу і отруєнню. Єдиним недоліком такого електрода є токсичність пари ртуті. Тому необхідно дотримуватися спеціальних правил техніки безпеки при роботі з ртутним електродом. У сучасній П. також застосовують тверді мікроелектроди, виготовлені з платини, золота, різних вуглецевих матеріалів: графітних стрижнів, графітних паст тощо. Ці електроди дозволяють працювати у більш позитивній області потенціалів, ніж ртутні. Проте вони мають низку серйозних недоліків: у таких електродів не відбувається постійного оновлення поверхні, як у ртутних, і на електродах нагромаджуються продукти електролізу, що робить їх потенціал погано відтворюваним; матеріал електрода робить специфічний вплив на електродний процес. Для зменшення цих недоліків твердий мікроелектрод обертають із постійною швидкістю, що приводить до очищення його поверхні. При полярографічному аналізі водних розчинів, окрім класичної П., найбільше застосування знаходять диференційна та інверсійна П.
Диференційна П. заснована на диференціюванні звичайних полярограм і отриманні залежності dI/dE = f(E). На такій полярограмі з’являються чітко виражені максимуми, що відповідають потенціалам напівхвиль іонів, які окиснюються або відновлюються в суміші, що аналізують. Диференційну П. використовують при аналізі суміші іонів з близькими значеннями Е½. Диференційну полярограму отримують графічним диференціюванням звичайної полярограми чи диференціюванням її безпосередньо полярографом з автоматичним записом.
Інверсійна П. катіонів або аніонів заснована на виділенні шляхом електролізу з розчину і концентруванні іонів, які аналізують у краплі ртуті мікроелектрода, що висить, або на поверхні твердого електрода з подальшим електролізним розчиненням продуктів, які утворилися. На кривій залежності струму розчинення від напруги утворюється «обернений пік», глибина якого (h) пропорційна концентрації іона, що аналізують. Інверсійну П. застосовують при аналізі дуже розбавлених розчинів — до 10–9 моль/дм3. Проте час аналізу при цьому різко зростає і становить декілька десятків хвилин.
Важливою перевагою П., порівняно з іншими електрохімічними методами аналізу, є можливість використання її як для якісного, так і кількісного аналізу. При цьому, незалежно від виду аналізу, обов’язковим є отримання полярограми розчину, що аналізують. Один із параметрів полярограми — потенціал напівхвилі (Е½) є тільки функцією природи іона, що відновлюється чи окиснюється на мікроелектроді. Тому ця величина може бути використана для його ідентифікації. Величина граничного дифузійного струму Iдиф є функцією концентрації іона, що відновлюється чи окиснюється, на крапельному ртутному електроді. Цю залежність описують рівнянням Ільковича:
Iдиф = 708,1 · n · D1/2 · m2/3 · τ1/6 · с,
де n — кількість електронів, що беруть участь у реакції окиснення або відновлення; D — коефіцієнт дифузії (см2/с); m — маса краплі ртуті, що утворюється за 1 с (мг); τ — час життя краплі ртуті (с); с — концентрація іона (моль/дм3). Якщо полярографування проводять при однакових параметрах крапельного ртутного мікроелектрода, то всі вхідні величини в рівнянні Ільковича будуть сталими і рівняння матиме вигляд:
Iдиф =К · с.
Таким чином, величина граничного дифузійного струму є лінійною функцією концентрації іона, що аналізують. Константу рівняння К зазвичай визначають за полярограмою стандартних розчинів, і тоді рівняння може бути використано для розрахунку концентрації іона, що аналізують, за величиною Iдиф. Проте цей метод використовують рідко. Найчастіше використовують метод градуювального графіка, побудованого в координатах Iдиф — с. Це пряма лінія, що проходить через початок координат.
Метод зазвичай застосовують при виконанні серійних аналізів. При побудові градуювального графіка часто замість величини граничного дифузійного струму відкладають просто висоту полярографічної хвилі h, виміряної на полярограмі в міліметрах. При виконанні невеликих серій аналізів застосовують метод порівняння зі стандартними розчинами. У цьому методі в одних і тих самих умовах знімають полярограми стандартного розчину і розчину, що аналізують, вимірюють висоти полярограм і розраховують концентрацію іонів, що аналізують (сх), за рівнянням:
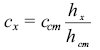 ,
,
де hх і hст — висота хвиль на полярограмі розчину, що аналізують, і стандартного розчину відповідно (мм); сх і сст — концентрація розчину, що аналізують, і стандартного розчину відповідно (моль/дм3).
При аналізі розчинів, якісний склад яких точно невідомий, зазвичай застосовують метод добавок стандартного розчину. Його суть полягає в тому, що спочатку знімають полярограму розчину, що аналізують, і на ній визначають величину граничного дифузійного струму Iдиф, який пов’язаний з концентрацією сх розчину, що аналізують, рівнянням:
Iдиф = Ксх.
Після цього до розчину, що аналізують, додають добавку — стандартний розчин цього ж іона, сдоб, знімають полярограму розчину і на ній визначають величину граничного дифузійного струму Iдоб, який дорівнює:
Iдоб = К(сх + сдоб).
Вирішують систему рівнянь щодо сх:
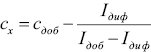 .
.
Слід зазначити, що метод полярографічного аналізу застосовують до широкого кола хімічних об’єктів. Метод П. дозволяє в одній пробі виконати якісний і кількісний аналіз із використанням однієї полярограми. Тому цей метод досить експресний, а його відносна похибка — у межах 2–3%. Межа виявлення цим методом не менше 10–4 моль/дм3, а при поєднанні з хроматографією досягає 10–9 моль/дм3.
Безуглый В.Д. Полярография в химии и технологии полимеров. — М., 1989; Салихджанова Р.М.-Ф., Гинзбург Г.И. Полярографы и их эксплуатация в практическом анализе и исследованиях. — М., 1988.
