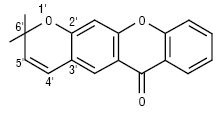
КСАНТОНИ — органічні сполуки рослинного походження, похідні дибензо-γ-пірону. Назва походить від грец. xanthos або xanhtus, що означає жовтий, оскільки речовини мають зазвичай кремовий або жовтий колір. Першого представника цієї групи було виділено з коренів Gentiana lutea і названо гентизином у 1921 р., пізніше була встановлена і підтверджена синтезом його структура — 1,7-діокси-3-метоксиксантон. Плідні дослідження К. ведуться з 1969 р. в Японії, Франції, США, Швеції, Індії та країнах СНД. У наш час із 150 рослин родин тирличевих, істодових, звіробійних й тутових виділено і вивчено близько 300 ксантонових сполук. Ще більше К. знайдено у грибах.
К. зазвичай класифікують на 5 груп:
1) власне ксантони — це дибензо-γ-пірони, заміщені в положеннях 1–8 окси-, алкокси-, алкільними групами, С- і О-глікозильними залишками й атомами хлору:
2) пірано- і дигідропіраноксантони лінійні й ангулярні:
лінійний піраноксантон
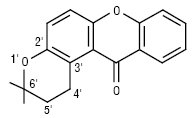
ангулярний дигідропіраноксантон
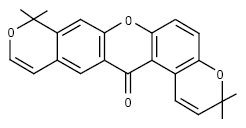
3) дипіраноксантони:
4) ксантолігноїди:
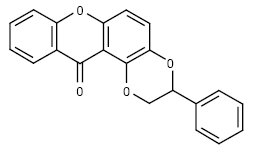
5) фураноксантони:
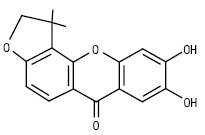
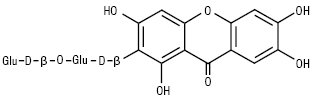
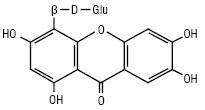
За кількістю замісників власне ксантони поділяються на моно-, ди-, три-, тетра-, пента-, гекса-, гепта- і октазаміщені. Найчастіше зустрічаються три- та чотиризаміщені сполуки. Монозаміщені К. зустрічаються в родині звіробійних — це 2-оксиксантон, його метиловий ефір і 4-оксиксантон. Дизаміщені К. зустрічаються у вільному вигляді тільки в родині звіробійні. Це зазвичай заміщені гідроксильними і метоксильними групами в положеннях 1 і 5 або 1 і 7. Їх нараховується 20 сполук. Тризаміщені К. знайдені в родинах тирличевих, звіробійних, істодових у вільному і глікозидованому вигляді. Їх нараховується понад 60 речовин. Цукрова частина представлена монозою — β-D-глюкопіранозою або біозами — примверозою (з’єднані зв’язком 1→6 ксилоза і глюкоза) і рутинозою (з’єднані зв’язком 1→6 рамноза і глюкоза). Зазвичай це D-глікозиди. У тирличевих заміщення відбуваються по 1,3,5- або 1,3,7-положеннях, у звіробійних — у 1,3,5-; 1,5,6-; 1,6,7- або 2,3,4-положеннях, у істодових К. виявлені в 2 видах Polygala arillata і P. tryplrylla, заміщення спостерігається в положеннях 1,2,3. Тетразаміщені К. знаходяться в родинах тирличевих — тип заміщення 1,3,7,8 і 1,3,5,8; звіробійні — тип заміщення 1,3,6,7; 1,3,5,6 і 1,3,4,5. По одній сполуці знайдено в родинах Lythraceae і Fabaceae. Вони являють собою О-глікозиди D-глюкози, примверози й рутинози. Пентазаміщені К. становлять найбільшу групу, поширені в родинах тирличевих, звіробійних, бобових та ін. Для тирличевих характерні такі типи заміщення: 1,2,3,6,7; 1,2,3,4,5; 1,3,5,6,7. Вони утворюють О- і С-глікозиди. У родині бобових в одному роді Hedisarum знайдені власне К., основним з них є пентазаміщений мангіферин і його похідні: глюкомангіферин — 2-С-β-D-глюкопіранозил глюкопіранозид-(1’’-6’’)1,3,6,7 тетраоксиксантон і глюкоізомангіферин.
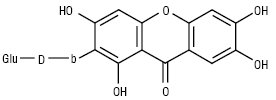
Глюкомангіферин
Мангіферин
Глюкоізомангіферин
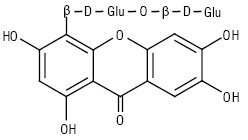
Найбільш поширеними в рослинному світі К. сполуками є мангіферин і його ізомери: гомомангіферин, ізомангіферин.
Ізомангіферин
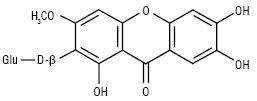
Гомомангіферин
Мангіферин є основним компонентом ксантонів Hedisarum flavescens, H. аlpinum. Для родини звіробійних характерні такі типи заміщень: 1,2,3,5,6; 1,2,3,6,7; 1,3,4,5,6. Причому дуже часто радикалами є ізопренільні залишки. Напр., молекули коваксантону і рубраксантону мають по два ізопренільних радикали.
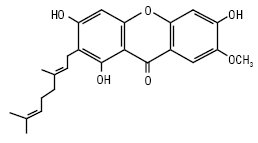
Ковоксантон
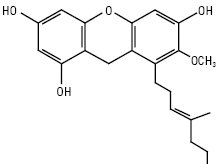
Рубраксантон
Гексазаміщені К. знаходяться в родині звіробійних. Заміщення відбувається у положеннях 1,2,3,5,6,7 зазвичай гідроксильними, метоксильними та ізопренільними радикалами. Гепта- й октазаміщені К. виявлені в лишайниках. До октазаміщених К. належить тіофанова кислота, знайдена в Lecanora carpathica.Сполука унікальна ще й тому, що молекула містить чотири атоми хлору, хоча зазвичай в грибах і лишайниках К. містять від одного до трьох атомів галогенів.
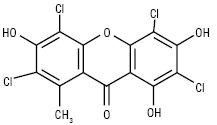
Тіофанова кислота
Пірано- і дигідропіраноксантони характерні для рослин родин Polygalaceae і Guttiferae, а також для деяких грибів. Плодові тіла окремих поганок яскраво флуоресціюють в УФ-світлі, що обумовлено наявністю деяких піраноксантонів. Піраноксантони можна розділити на групи: моно-, ди-, три-, тетра-, пентапіраноксантони і дигідропіраноксантони. Цукровий залишок представлений тільки β-глюкозою. Деякі з них наведено нижче:
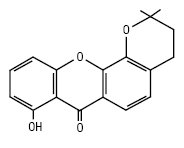
6-дезоксіякареубін (Calophyllum)
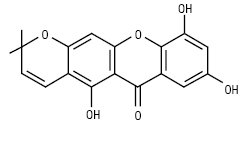
Озаяксантон (Maclura pomifera)
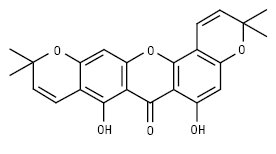
Маклюроксантин (Maclura pomifera)
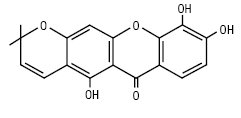
Якареубін (Hypericaceae)
Фураноксантони у 1977 р. були знайдені в грибах, зокрема у роді Aspergillus. Небезпечним є ксантоновий метаболіт плісені, що забруднює харчові продукти, — стеригматоцистин. Цей фураноксантон синтезується грибком Aspergillus versicolor. Окрім токсичних властивостей, стеригматоцистин має канцерогенну дію, хоча до сильних канцерогенів не належить. Більш важливо, що він є біосинтетичним попередником афлатоксинів — небезпечних канцерогенних забруднювачів харчових і кормових продуктів.
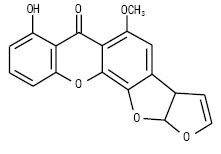
Стеригматоцистин
Серед вищих рослин фураноксантони знайдені в рослинах родини Guttiferae (напр. редіаксантон). Виділений з кори коренів африканської рослини Psorospermum febrifugum дигідрофураноксантон псороспермін проявляє сильну цитотоксичну і протипухлинну дію і має перспективи клінічного використання.
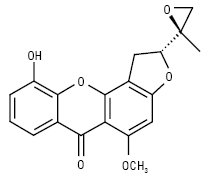
Псороспермін
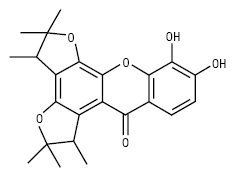
Редіаксантон
Ксантолігноїди в структурі молекули, крім фрагменту ксантона, містять фрагмент лігнанів:
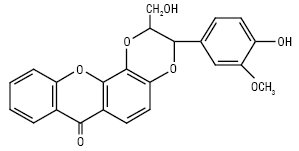
Кількорин (Hypericum perforatum, корені)
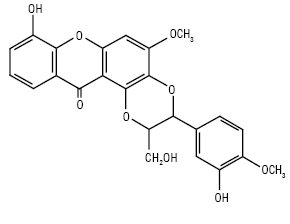
Гадензин А (Vismia guaramirangae)
Відомо декілька структурних типів димерних К. З рослини Swertia hirata виділений хірантин, мономерні фрагменти в якому зв’язані в димерну структуру С–О зв’язком. Димери іншого виду синтезуються грибами, зокрема Claviceps purpurea. Серед сполук, які утворюються, є темнозабарвлені ергохроми, представником яких є секалова кислота. Ця сполука стимулює імунітет в організмах ссавців. Деякі напівсинтетичні похідні її вивчаються як перспективні імуномодулятори для лікування інфекційних захворювань та пухлин. У той же час ергохроми є мікотоксинами, у субтоксичних дозах призводять до ураження печінки при потраплянні в організм з хлібом.
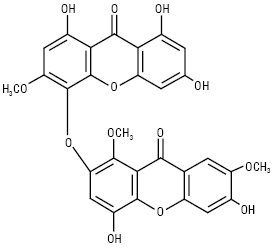
Хірантин
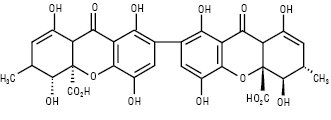
Секалова кислота
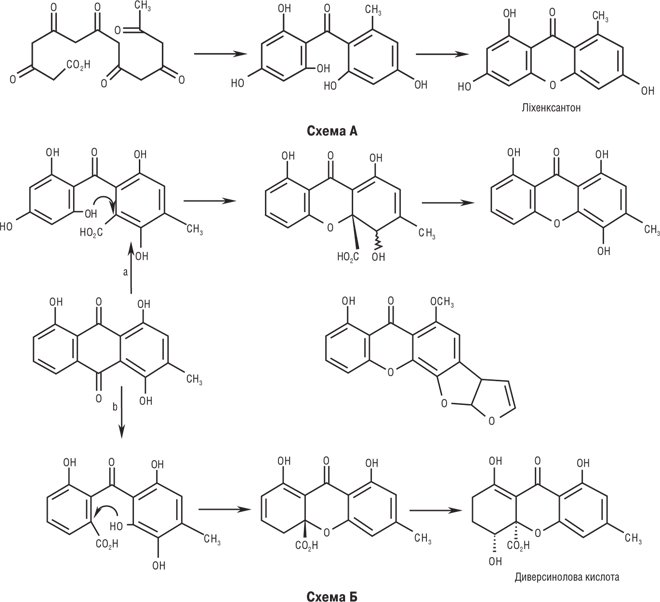
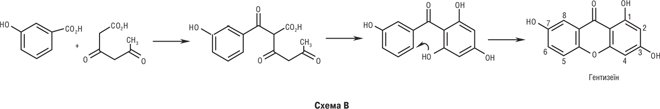
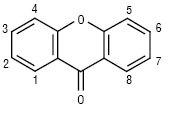
К. у природі утворюються внаслідок трьох типів біосинтетичних процесів. Для лишайників найбільш характерний спосіб А побудови ксантонового скелета з гептакетидного попередника через похідні бензофенону. Більшість інших лишайникових К. є продуктами модифікацій і ускладнень ліхенксантону. Деякі К. грибів у своєму біосинтезі також проходять шлях А, але в більшості випадків їх попередниками є антрахінони. Окисне розщеплення останніх дає два різних бензофенони (варіанти Ба і Бб), циклізація яких приводить до утворення дигідроароматичних кислот. Одна з них шляхом окисного декарбоксилювання перетворюється на равенелін. З нього утворюється більшість грибних К. Менша частина їх утворюється при аналогічних перетвореннях диверсинолової кислоти. У рослин функціонує третій шлях біосинтезу (схема В). Трикетид ацилюється м-гідроксибензойною кислотою шикіматним біосинтетичним шляхом. Утворюється найпростіший представник рослинних дибензопіронів — гентизеїн.
Методи виділення, якісні реакції й встановлення структури. Повітряно-суху сировину обробляють нижчими спиртами; спиртовий екстракт упарюють до водяного залишку, з якого виділяють фенольні сполуки органічними розчинниками, починаючи з малополярних і поступово замінюючи їх на більш полярні, тобто проводять фракціонування. Так, К. з кількома метоксильними групами, піраноК. екстрагуються хлороформом, хлористим метиленом. Глікозиди К. будуть екстрагуватися або бутанолом, залежно від своєї полярності, або етилацетатом. Зазвичай рослини містять від кількох до 20 ксантонових сполук, тому отримані комплекси вибірковою екстракцією розділяють на індивідуальні компоненти за допомогою колонкової і ТШХ, застосовуючи різні сорбенти: поліамід, силікагель, целюлозу, сефадекс та ін. Використовуючи силікагель, розділяють аглікони і глікозиди. На целюлозі К. елююють оцтовою кислотою, починаючи з 5% і поступово підвищуючи її концентрацію до 80%. К. властиві реакції із загальними реактивами для фенолів: солями заліза, ацетатом свинцю, хлоридом алюмінію. В УФ-спектрах К. мають зазвичай чотири смуги поглинання: при 230–260, 260–290, 285–300 і 325–395 нм. За допомогою іонізуючої добавки ацетату натрію визначають вільні гідроксильні групи в положеннях С-3 і С-6: спостерігається батохромний зсув максимумів поглинання на 40–50 нм у довгохвильовій області спектра. З хлоридом алюмінію К., що мають вільні гідроксильні групи в положеннях С-1 і С-8, дають батохромний зсув максимумів на 20 нм у короткохвильовій і на 60 нм у довгохвильовій області УФ-спектра. Ортогідроксигрупа визначається борною кислотою з ацетатом натрію. Комплекс алюмінію з карбонілом-гідроксилом руйнується при додаванні хлоридної кислоти, що виражається у зникненні батохромного зсуву. Пара-положення гідроксильних груп визначають за допомогою реакції Гіббса: з 2,6-дихлорбензохінонхлоридом. К. переважно містяться в рослинах родин тирличевих, звіробійних, тутових, а також істодових, логанієвих, аспідових, бобових, ірисових, сумахових. Локалізуються К. в різних частинах рослин: квітках, плодах, листі, стеблах, коренях, деревині. Вважається, що К. беруть участь в окисно-відновних процесах, виконують захисні функції при інфікуванні рослин.
Біологічна активність К. залежить від їх структури. Мангіферин стимулює ЦНС, у високих дозах спричиняє кардіотонічну й діуретичну дію; виявляє антибактеріальну і протизапальну дію. На основі мангіферину з трави солодушки альпійської (Hedysarum alpinum L.) одержують препарат Алпізарин, який використовують для лікування герпесу та інших вірусних захворювань. К. із заміщенням у положеннях 1,3,5,8 мають антивірусні властивості; у 1,3,7,8 — протитуберкульозна дія, в 1,6 і 1,3 є інгібіторами саркоми; у 1,8,3 мають протигрибкову дію.
Блажий А., Шутый Л. Фенольные соединения растительного происхождения. — М., 1997; Глызин В.И., Николаева Г.Г., Даргаева Т.Д. Природные ксантоны. — Новосибирск, 1986; Гудвин Т., Мерсер Э. Введение в биохимию растений. В 2 т. — М., 1986.; Семенов А.А. Очерк химии природных соединений. — Новосибирск, 2000.; Sultanbawa M.U. S. Xantoids of tropical plants // Tetrahedron. — 1980. — Vol. 36, № 11.