КИСЛОТА НІТРИТНА, азотиста, (Acidum nitrosum) HNO2 — безбарвна речовина, існує у вигляді пари або водного розчину. Нагрівання пари або її конденсація, а також концентрування водних розчинів ведуть до розкладання К.н.: у парі — 2HNO2 ↔NO+NO2+H2O; у розчині — 3HNO2↔HNO3+2NO+H2O. Сильні неорганічні кислоти каталізують розкладання. Існує ангідрид Н.к. (N2O3). Продукти розкладання К.н. — нітроген (II) оксид (NO), нітроген (ІІІ) оксид (N2O3), нітроген (IV) оксид (NO2) є отруйними. У лабораторії та промисловості К.н. одержують дією неорганічних кислот на нітрити, напр.: KNO2+HCl=HCl+HNO2. К.н. — одноосновна кислота середньої сили (при 12,5 оС pKа=3,37; Kд=4·10–4; ступінь дисоціації в 0,1 М водному розчині — 6,5%). Для неї цілком імовірні дві таутомерні форми:

(І) (ІІ)
Для кожної з них відомі свої ряди комплексних сполук та органічних похідних, які містять відповідно нітрогрупу NO2 та нітритогрупу ONO. При 298 К рівноважна суміш містить 0,309 мольних часток (I) та 0,691 мольних часток (II): для газоподібних (I) та (II) Ср° відповідно 45,4 та 46,0 Дж/ (моль·К); ΔH°утв. = –77,4 кДж/моль та –79,5 кДж/моль; ΔG°утв. = –42,6 кДж/моль та –44,6 кДж/моль; S°утв.=249 Дж/(моль·К). У зв’язку з тим, що атом нітрогену в К.н. знаходиться в проміжному ступені окиснення +3, HNO2 має окисно-відновну двоїстість. У реакціях з відновниками, такими як I–, S2–, Fе2+, К.н. виявляє окисні властивості, відновлюючись при цьому до NO:
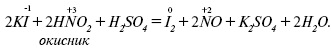
При дії аніонів — окисників, таких як ClO3–, MnO4–, Cr2O72– і деяких інших К.н. окиснюється до нітратної кислоти:

З основами К.н. утворює солі — нітрити. Найбільш поширеними є нітрити K, Na, Ca — безбарвні кристали, добре розчинні у воді (крім AgNO2) і відносно стійкі у навколишньому середовищі. Водні розчини нітритів легко розкладаються з підвищенням температури та під дією світла. Нітрити одержують, пропускаючи N2O3 і NO2 через розчини лугів.
Токсична дія К.н. (її солей та естерів) на організм зумовлена впливом на серцево-судинний та дихальний центри ЦНС. У фармацевтичній практиці солі К.н. (напр. NaNO2), а також її естери (напр. ізоаміловий естер К.н., C5H9NO2 — прозору жовтувату рідину з фруктовим запахом, поганорозчинну у воді, але добрерозчинну у спирті, естері, хлороформі), використовують як засоби, які розширюють серцеві судини. Препарати на основі К.н. є метгемоглобіноутворювачами, їх використовують як антидоти при отруєнні ціанідною кислотою та її солями. Утворений гемоглобін зв’язує ціаніди за реакцією:

БМЭ. — М., 1974. — Т. 1; 1981. — Т. 17; Машковский М.Д. Лекарственные препараты: В 2 т. — К., 2000. — Т. 1; Суховєєв В.В., Сенченко Г.Г., Ковтун Г.О., Приплавко С.О. Металовмісні лікарські препарати. — К., 2000; Химическая энциклопедия. — М., 1988. — Т. 1.
