КИСЛОТА НІТРАТНА (азотна), HNO3 (Acidum nitricum) — безбарвна рідина, Tкип. = 84 °С; Tпл .= –41,6 °С. Технічна HNO3 (61–68%); розведена HNO3 (54–60%), димуча HNO3 (86–99,5%) має густину 1,52 г/см3 і вже при кімнатній температурі під дією світла частково розкладається з утворенням NO2, що зумовлює її жовте забарвлення: 4HNO3 = 4NO2 + 2H2O + O2. К.н. з масовою часткою HNO3 65% називають концентрованою. Будову молекул HNO3 та NO3–-іона зображено на схемі:
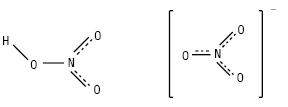
К.н. з масовою часткою 98% у лабораторних умовах одержують кип’ятінням нітратів калію або натрію з концентрованою сульфатною кислотою: 2KNO3 + H2SO4(к) = 2HNO3 +K2SO4. У техніці К.н. одержують окисненням аміаку до нітроген (II) оксиду за наявності каталізатора (сітка зі сплаву платини з родієм), нітроген (ІІ) оксиду — до нітроген (ІV) оксиду, який потім розчиняють у гарячій воді за наявності кисню повітря: 4NH3 + 5O2 = 4NO + 6H2O; 2NO + O2 = 2NO2; 4NO2 + 2H2O+O2 = 4HNO3. К.н. є однією з найсильніших кислот. У розведених водних розчинах вона повністю дисоційована на іони: HNO3 → H+ + NO3+. З хімічної точки зору HNO3 є сильним окисником. Вона окиснює більшість металів і неметалів. Неметали при дії Н.к. окиснюються в оксигенвмісні кислоти з вищим ступенем окиснення кислотоутворювального неметалу:
![]()
Продукти відновлення К.н. металами залежать від фізико-хімічної природи металу, від концентрації кислоти та температури. Чим вища концентрація HNO3, тим менше відновлюється нітроген. Слід зазначити, що в процесі відновлення К.н. утворюється суміш сполук, в яких нітроген знаходиться в різному ступені окиснення від +4(NO2) до –3(NH4NO3), напр.: 4Ca+10HNO3(дуже розв.) =4Ca(NO3)2+NH4NO3+3H2О. Більш сильну окиснювальну дію виявляє суміш концентрованих нітратної та хлоридної кислот (1:3) — царська вода. Вона розчиняє «царя металів» — золото: Au+HNO3+3HCl=AuCl3+NO+2H2O. Солі К.н. — нітрати одержують дією HNO3 на метали, оксиди, гідроксиди та карбонати. Нітрати досить стійкі при звичайних температурах, але при нагріванні розкладаються з виділенням кисню: 2KNO3 = 2KNO2 + O2↑.
Пари HNO3, яка містить NO2, N2O5 і туман прозорої К.н., подразнюють дихальні шляхи, викликають руйнування зубів, кон’юнктивіти, а також ураження рогівки ока. Розведені розчини К.н. іноді викликають екземи. ГДК К.н. у повітрі — 0,4 мг/м3. Багато органічних матеріалів (солома, тирса, одяг), облиті концентрованою К.н., спалахують; спирт, скипидар — вибухають. Тому робота з концентрованою HNO3 потребує особливої обережності. При потраплянні її крапель на шкіру утворюються опіки у вигляді жовтих плям — продуктів нітрування речовин білкової природи, які містять бензольні кільця. У медичній практиці застосовують чисту К.н. — прозору безбарвну рідину, вміст HNO3 якої становить 32–33% (для лікування деяких захворювань шкіри: бородавок, судинних родимок, папілом та ін.), а також деякі солі К.н. (напр. BiOHNO3) як в’яжуча та антисептична речовина при захворюваннях ШКТ. Аргентум нітрат (AgNO3) з білками утворює нерозчинні альбумінати, пригнічує ферментативні системи, через що знижує життєдіяльність багатьох мікробів. При невисоких концентраціях аргентум нітрат чинить в’яжучу та протизапальну дію, а при більш високих — припалює тканини і виявляє бактерицидну активність. Органічні нітрати широко застосовують як ЛП (найчастіше для лікування ішемічної хвороби серця): нітрогліцерин, пентаеритрилу тетранітрат, ізосорбіду динітрат.
БМЭ. — М., 1974. — Т. 1; 1980. — Т. 9; Машковский М.Д. Лекарственные препараты: В 2 т. — М., 2000. — Т. 1; Суховєєв В.В., Сенченко Г.Г., Ковтун Г.О., Приплавко С.О. Металовмісні лікарські препарати. — К., 2000; Химическая энциклопедия. — М., 1988. — Т. 1.
