Ізомерія (лат. isomeria < грец. isos — однаковий + meros — частина) — явище, яке полягає в існуванні сполук (ізомерів), що мають однакові молекулярні формули, але відрізняються порядком зв’язування атомів у молекулі чи розташуванням атомів у просторі, внаслідок чого вони є відмінними за фізичними і хімічними властивостями. Термін «ізомерія» вперше був уведений у 1830 р. Розрізняють два основні види ізомерії — структурну (Ізомерія будови) і просторову (стереоізомерія).
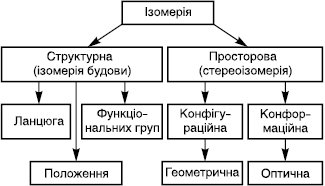
Структурна Ізомерія — явище існування сполук, які мають однакові молекулярні формули, але відрізняються порядком сполучення атомів у молекулі. Структурна ізомерія поділяється на ізомерія ланцюга, положення та ізомерія функціональних груп.
Ізомерія ланцюга зумовлена різною послідовністю зв’язування атомів, які утворюють вуглецевий кістяк молекули. Напр., бутан та ізобутан:
СН3–СН2–СН2–СН3 СН3–СН(СН3)–СН3
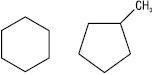
Для органічних сполук циклічної будови І. ланцюга може бути спричинена розміром циклу. Напр., циклогексан і метилциклопентан:
Ізомерія положення зумовлена різним положенням функціональних груп, замісників чи кратних зв’язків у молекулі.
бутанол-1 СН3СН2СН2ОН;
бутанол-2 СН3СН2СН(ОН)СН3;
бутен-1 СН2=СН–СН2–СН3;
бутен-2 СН3–СН=СН–СН3
Ізомерія функціональних груп зумовлена присутністю в ізомерах однакового складу різних за природою функціональних груп: етанол — диметиловий етер:
СН3–СН2–OH СН3–O–СН3
Просторова ізомерія— явище, яке полягає в існуванні сполук з однаковими молекулярними формулами, однаковою послідовністю сполучення атомів у молекулі, але з різним розташуванням атомів у просторі. Просторові ізомери називають також стереоізомерами (грец. stereos — просторовий). Просторова І. поділяєтся на конфігураційну і конформаційну.
Конфігураційна ізомерія включає оптичну та геометричну.
У 1815 р. Ж. Біо відкрив існування оптичної активності для органічних сполук. Було встановлено, що деякі органічні сполуки мають здатність обертати площину поляризації поляризованого світла. Речовини з такою здатністю називають оптично активними. Оптичну активність вимірюють за допомогою приладів, які називають поляриметрами. Під час проходження поляризованого променя крізь оптично активну речовину площина поляризації обертається на певний кут [α] ліворуч чи праворуч. Якщо речовина відхиляє площину поляризації праворуч (при спостереженні назустріч променю), її називають правообертальною (+), якщо ліворуч — лівообертальною (–).
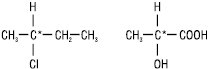
Явище оптичної активності поширене серед органічних речовин, особливо природних (гідрокси- й амінокислот, білків, вуглеводів, алкалоїдів). Оптична активність більшості органічних сполук зумовлена їх будовою. Однією з причин виникнення оптичної активності органічних молекул є наявність у структурі sp3-гібридизованого атома карбону, зв’язаного з чотирма різними замісниками. Такий атом карбону називається хіральним або асиметричним (хіральний центр). У структурних формулах асиметричний атом вуглецю позначають зірочкою — С*:
Асиметричними можуть бути й інші атоми, напр. атом нітрогену, сульфуру, фосфору. Оптичну активність виявляють також сполуки, які не містять асиметричного атома — це похідні алену, адамантану, фероцену, ізомерія яких викликана відсутністю обертання навколо простого зв’язку, так звана атропізомерія. Оптична активність характерна також для спіральних конформацій білків, нуклеїнових кислот, гексагеліценів.
Сполуки, які містять один асиметричний атом карбону, існують у вигляді двох ізомерів, котрі співвідносяться як предмет до свого дзеркального відображення. Такі ізомери називають енантіомерами:
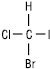
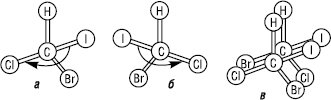
Моделі енантіомерних молекул бромйодхлорметану
Для відображення просторової будови оптичних ізомерів на площині можуть бути використані стереохімічні формули — енантіомери бутанолу-2:
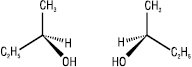
Частіше оптичні ізомери зображують на площині за допомогою проекційних формул Фішера:

Енантіомери схожі між собою, але не тотожні, вони мають однаковий склад і послідовність зв’язування атомів у молекулі, але відрізняються один від одного відносним розташуванням атомів у просторі, тобто конфігурацією. Здатність молекул не суміщуватися зі своїм дзеркальним відображенням називають хіральністю (грец. cheir — рука), а такі молекули називають хіральними. Молекули, сумісні зі своїм дзеркальним відображенням, називають ахіральними. Хіральність молекул є обов’язковою умовою для виявлення речовиною оптичної активності. Оскільки молекула — тривимірне утворення, її будову можна розглядати з погляду симетрії геометричних фігур. Основними елементами симетрії є площина, центр і вісь симетрії. Якщо у молекулі відсутня площина симетрії, то така молекула хіральна. Енантіомери мають однакові фізичні і хімічні властивості, обертають площину поляризації поляризованого променя на один і той же за величиною, але протилежний за напрямком кут; вони з різною швидкістю реагують з іншими хіральними сполуками і відрізняються за фізіологічною дією.
Для порівняльної оцінки оптичної активності різних сполук використовують значення питомого обертання [α]. Питоме обертання є константою оптично активної речовини, яке характеризує оптичну активність розчину з концентрацією оптично активної речовини 1 г/мл при товщині шару 1 дм.
Для речовин у розчині [α]= α·100/l·c, де α — виміряний кут обертання, град.; l — товщина шару, дм; с — концентрація оптично активної речовини, г/100 мл розчину.
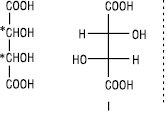
Якщо молекула має декілька асиметричних атомів карбону, то кількість можливих ізомерів збільшується. Кількість оптичних ізомерів визначають за формулою: N=2n, де N — кількість ізомерів; n — кількість асиметричних атомів карбону. Для бромяблучної кислоти, що містить два асиметричних атоми, існує чотири стереоізомери (I–IV).
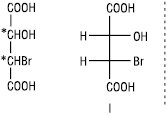
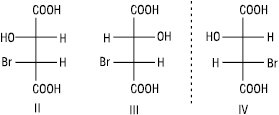
Стереоізомери I та II, а також III та IV є енантіомерами; стереоізомери I та III, I та IV, а також II та III, II та IV не є дзеркальними відображеннями один одного, вони відрізняються за конфігурацією при одному з асиметричних атомів карбону. Такі стереоізомери називають діастереомерами. На відміну від енантіомерів, діастереомери мають різні фізичні і хімічні властивості. Для сполук, які містять два хіральних атоми вуглецю, пов’язаних з однаковими замісниками, загальна кількість стереоізомерів зменшується до трьох.
Напр., винна кислота має існувати у вигляді чотирьох стереоізомерів (22=4), а їх відомо лише три:
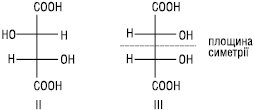
Стереомери I та II є енантіомерами. Стереоізомер III (мезо-форма) є оптично неактивним. Молекула мезовинної кислоти ахіральна. Кожен енантіомер винної кислоти щодо мезо-форми є діастереомером.
Номенклатура оптичних ізомерів. При формуванні назв оптично активних сполук поряд з назвою сполуки вказують також конфігурацію і знак обертання. Для позначення конфігурації оптичних ізомерів існують D,L- і R,S-стереохімічні системи.
D,L-система позначення конфігурації. Встановити абсолютну конфігурацію молекул вперше вдалося лише в 1951 р. методом рентгеноструктурного аналізу. До цього часу конфігурацію оптичних ізомерів встановлювали методом порівняння зі спеціально підібраною стандартною речовиною. Така конфігурація одержала назву відносної. У 1906 р. російським ученим М.А. Розановим як стандарт для встановлення відносної конфігурації був запропонований гліцериновий альдегід:
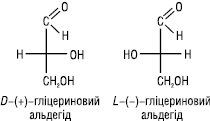
У формулі Фішера правообертальний ізомер містить гідроксильну групу у хірального атома карбону праворуч, а лівообертальний — ліворуч. Конфігурація правообертального ізомера позначається буквою D, а лівообертального — L. D,L-систему в основному застосовують у разі багатоатомних спиртів, гідрокси-, амінокислот і вуглеводів.
Для сполук з декількома асиметричними атомами карбону віднесення до D- чи L-ряду визначають за конфігурацією при верхньому асиметричному атомі карбону (амінокислоти, винні кислоти та ін.), у вуглеводах — за конфігурацією при нижньому.
R,S-система позначення конфігурації була запропонована Р. Каном, К. Інгольдом і В. Прелогом (абсолютна конфігурація). R,S-система побудована на визначенні старшинства замісників у хірального центру.
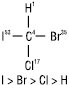
Згідно з R,S-системою старшинство замісників визначається атомними номерами елементів. Чим більшим є атомний номер, тим старше замісник:
53I > 35Br > 17Cl > 1H
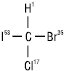
Після встановлення старшинства молекулу орієнтують так, щоб замісник з найменшим порядковим номером знаходився якнайдалі від спостерігача. Якщо старшинство трьох інших замісників зменшується за годинниковою стрілкою, то молекула має конфігурацію R (лат. rectus — правий), а якщо старшинство замісників зменшується проти годинникової стрілки, конфігурацію позначають буквою S (лат. sinister — лівий):
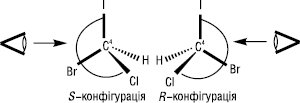
Старшинство замісників для більш складних молекул встановлюється шляхом підрахунку атомних номерів елемента, спочатку безпосередньо зв’язаних з хіральним центром, а потім, якщо це необхідно, — елементів наступних елементних шарів. Суміш еквімолекулярної кількості енантіомерів називають рацемічною сумішшю (рацематом). Рацемати відрізняються від індивідуальних енантіомерів фізичними властивостями — вони можуть мати різну температуру плавлення, розчинність, відрізнятися за спектральними характеристиками.
Для розподілу рацематів на енантіомери використовують три методи:
- Механічний. У результаті кристалізації деяких оптично активних сполук можуть утворюватися дві форми кристалів, схожих одна на одну як предмет та його дзеркальне відображення. Їх можна відокремити під мікроскопом препаративною голкою (механічно);
- Біохімічний метод базується на тому, що певні види мікроорганізмів віддають перевагу одній з енантіомерних форм та з’їдають її, а інша залишається і може бути легко виділена;
- Хімічний, в основі якого лежить переведення енантіомерів за допомогою оптично активних реагентів у діастереомери, що відрізняються за фізичними властивостями.
Геометрична ізомерія характерна для сполук, які містять подвійний зв’язок, та сполук аліциклічного ряду. Геометричні ізомери — це сполуки, що мають однакову молекулярну формулу, однакову послідовність зв’язування атомів, але відрізняються одна від одної різним розташуванням атомів або атомних груп у просторі відносно площини подвійного зв’язку або циклу. Причиною виникнення такої ізомерії є неможливість вільного обертання навколо подвійного зв’язку або σ-зв’язків, які утворюють цикл. Напр., бутен-2 СН3–СН=СН–СН3:
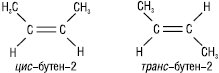
або 1,2-диметилциклопропан:

Для позначення конфігурації геометричних ізомерів, крім цис- та транс-, використовують E,Z-систему. E,Z-система є більш загальною, вона використовується для геометричних ізомерів з будь-яким набором замісників. В основі цієї системи лежить старшинство замісників, які визначають біля кожного атома карбону окремо. Якщо старші замісники з кожної пари розташовані по один бік від подвійного зв’язку, конфігурація позначається буквою Z (нім. zusammen — разом), якщо по різні боки — буквою E (нім. entgegen — навпроти):
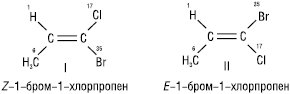
Геометричні ізомери мають різні фізичні і хімічні властивості, спектральні характеристики. Така різниця дозволяє досить легко установити їх конфігурацію за допомогою фізичних і хімічних методів.
Конформаційна І. Конформаційна (поворотна) І. зумовлена обертанням атомів або атомних груп навколо одного чи декількох простих σ-зв’язків, у результаті чого молекули можуть мати різні просторові форми, які називають конформаціями. Напр., молекула етану внаслідок обертання навколо С–С зв’язку може мати безліч конформацій, кожна з яких характеризується певним значенням потенційної енергії. Дві крайні конформації називають заслоненою і загальмованою.
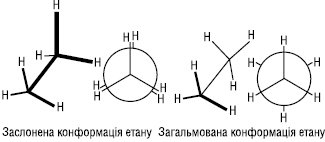
Заслонена конформація має максимальну енергію, а загальмована — мінімальну. Енергетична нерівноцінність конформацій пояснюється існуванням у молекулі торсійної напруги (напруги Пітцера), зумовленої взаємодією (відштовхуванням) електронних хмар протилежних зв’язків. Різниця енергій заслоненої і загальмованої конформації називається енергетичним бар’єром обертання. Для етану енергетичний бар’єр невеликий, становить близько 12 кДж/моль і легко переборюється молекулою за звичайних температур за рахунок енергії теплового руху.
При обертанні навколо С2–С3 зв’язку в н-бутані можливі 4 крайні конформації, з яких 2 загальмовані та 2 заслонені:
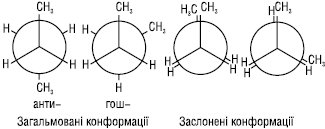
Загальмована конформація, у якій метильні групи максимально віддалені одна від одної, називається антиконформацією. Інша загальмована конформація називається гош-конформацією. Загальмована гош-конформація має дещо більшу потенційну енергію (за рахунок метил-метильної взаємодії), ніж антиконформація. Конформації з найменшим запасом енергії називають конформерами чи конформаційними (поворотними) ізомерами. На відміну від конфігураційних ізомерів, конформери перетворюються один в одного без розриву хімічних зв’язків і не піддаються розподілу. Їх виявляють тільки фізико-хімічними методами.
Біологічна дія природних сполук (білків, вуглеводів, ліпідів, гормонів), яка відіграє важливу роль у життєдіяльності організму, тісно пов’язана з просторовою будовою, адже саме вона забезпечує стереоспецифічність біохімічних процесів.
Практично всі амінокислоти, що складають структуру білка, крім гліцину і β-аланіну, мають однакову конфігурацію і належать до L-ряду. Елементарною ланкою вуглеводів є молекули моносахаридів. У природі знайдені моносахариди переважно з D-конфігурацією.
До складу жирів можуть входити як насичені, так і ненасичені жирні кислоти, які містять один чи кілька подвійних зв’язків у вуглецевому ланцюгу, що приводить до існування геометричних ізомерів. Експериментально встановлено, що зазвичай більш стійкими є Е- (транс-) ізомери. Природні ж ненасичені жирні кислоти — структури з Z- чи цис-конфігурацією. Вважають, що Z-конфігурація надає вуглеводневому ланцюгу компактної структури, що важливо при побудові біологічних мембран, до складу яких входять ліпіди.
Каталізаторами біохімічних процесів у живому організмі є такі оптично активні сполуки, як ферменти і гормони, що мають білкову природу. Біологічну активність ЛП пов’язують із суворою відповідністю структури препарату і певних рецепторів, що дозволяє їм взаємодіяти один з одним в організмі. Стереоспецифічність дії препаратів розглядають з урахуванням обох видів стереоізомерії: конфігураційної і конформаційної. Найчастіше відмічають взаємодію ЛП з одним із стереоізомерів біологічної молекули. У цьому разі говорять про стереоспецифічність дії БАР.
Відомо, що перший синтетичний антибіотик левоміцетин, який широко застосовують у медичній практиці, — один з чотирьох існуючих оптичних ізомерів п-нітрофеніл-2-дихлорацетиламінопропандіолу-1,3; лівообертальний ізомер адреналіну (гормон надниркової залози) у 12 разів активніший порівняно зі своїм правообертальним ізомером, а з енантіомерів природного алкалоїду ефедрину як ЛП застосовують D-(–)-ефедрин, а правообертальний ізомер (псевдоефедрин) як ЛП не застосовують. У деяких випадках знаходять застосування обидва стереоізомери. Напр., у медичній практиці використовують як природну правообертальну, так і синтетичну лівообертальну камфору.
Асиметрично побудовані молекули відрізняються не тільки ступенем своєї фізіологічної дії, але й токсичністю. Напр., молекула алкалоїду нікотину має хіральний атом карбону й існує у вигляді двох ізомерів. Виявилося, що правообертальний ізомер у 3 рази менш токсичний порівняно з лівообертальним; у листі тютюну синтезується більш отруйний лівообертальний енантіомер.
Стереоспецифічність дії ЛП виявляється не тільки під час взаємодії з рецепторами. Перш ніж відбудеться ця взаємодія, ЛР проходить складний шлях у живому організмі, на якому зустрічається з цілою низкою біологічних молекул, проникає крізь біологічні мембрани, а те, що стереоізомер реагує тільки з певними рецепторами, вказує на специфічність дії ЛП.
Днепровский А.С., Темникова Т.И. Теоретические основы органической химии. — Л., 1979; Кери Ф., Сандберг Р. Углубленный курс органической химии. В 2 кн. — М., 1975; Ногради М. Стереохимия: основные понятия и приложения. — М., 1984; Потапов В.М. Стереохимия. — М., 1976; Черных В.П., Зименковский Б.С., Гриценко И.С. Органическая химия / Под общ. ред. В.П. Черных. — 2-е изд. — Х., 2007.
