АЦЕТОН, Acetonum (Ph Eur), Acetone (USPNF, BP), 2-Propanone (CAS № 67–64–1); син.: пропанон, диметилкетон, dimethylformaldehyde, dimethyl ketone, β-ketopropane. А. — летка безбарвна рідина з характерним запахом (Tпл 94,6 °С, Tкип 59,1 °С; Tзайм 20 °С; d420 0,7920; nD20 1,3588; γ 0,0273 н/м (20 °С)), змішується з водою та органічними розчинниками; межа вибухонебезпечності суміші А. з повітрям — 2,5–12,8%.
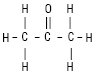
СН3СОСН3 Мол. м. 58,079.
За хімічними властивостями А. — типовий представник аліфатичних кетонів. Вступає в реакції нуклеофільного приєднання (з ціановодневою кислотою, гідросульфітами лужних металів, магнійорганічними сполуками), в реакції приєднання-відщеплення (з гідроксиламіном з утворенням кетоксиму, з гідразином і його похідними). Сильні окисники окиснюють А. до оцтової та мурашиної кислот і далі до вуглекислого газу і води.
У промисловості А. отримують прямим окисненням пропілену в рідкій фазі за наявності PdCl2:
![]()
та «кумольним способом» — одночасно з фенолом із бензолу і пропілену через ізопропілбензол (кумол):
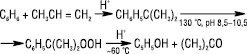
Відомі також інші способи отримання А.: взаємодія ацетилену з водяною парою при температурі 100 °С за наявності каталізаторів (оксиду цинку та заліза); ацетонове бродіння крохмалю та ін. А. міститься в сечі хворих на діабет (утворюється внаслідок декарбоксилювання ацетооцтової кислоти).
Для його визначення в крові хворих на діабет часто використовують таку реакцію:
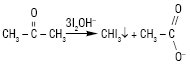
Проте в цих умовах можуть створювати й інші речовини.
Для якісного визначення А. використовують групові кольорові реакції: з динітробензолом (на групи СН3СО– або –СН2СО–); з нітропрусидом натрію (реакція Легаля). Кількісно А. визначають йодометрично та взаємодією з гідроксиламіном: (CH3)2CO + NH2OH·HCl → (CH3)2C=NOH + + HCl + H2O.
Утворену HCl титрують лугом.
Низькотоксичний А. використовують як розчинник у харчовій та фармацевтичній промисловості. А. широко застосовують як розчинник нітратів і ацетатів целюлози, як вихідну речовину в синтезі деяких ЛП, напр. йодоформу, хлоретону; також він є сировиною для синтезу оцтового ангідриду, кетену, діацетонового спирту.
При вдиханні А. він накопичується в організмі. Внаслідок повільного виведення А. можливе хронічне отруєння. ГДК — 200 мг/м3.
Нейланд О.Я. Органическая химия. — М., 1990; Черных В.П., Зименковский Б.С., Гриценко И.С. Органическая химия / Под общ. ред. В.П. Черных. — 2-е изд. — Х., 2007.
