АЦЕТИЛЕНОВІ ВУГЛЕВОДНІ (алкіни) — вуглеводні аліфатичного ряду, які містять один потрійний зв’язок –С≡С–. Загальна формула алкінів СnH2n-2. Найпростішим представником ряду є ацетилен (етин) С2Н2.
За замісниковою номенклатурою IUPAC назви А.в. утворюють від назв відповідних алканів, замінюючи суфікс -ан на -ин (-ін) з позначенням положення потрійного зв’язку в ланцюгу вуглецевих атомів. Нумерацію атомів карбону починають з того кінця, ближче до якого знаходиться потрійний зв’язок, напр. СН3СН(СН3)С≡ССН3 — 4-метилпентин-2. За раціональною номенклатурою А.в. називають похідними ацетилену, в молекулі якого атоми гідрогену заміщені на радикали: НС≡С–СН2–СН3 — етилацетилен. Ізомерія А.в. пов’язана з положенням потрійного зв’язку та розгалуженням вуглецевого ланцюга. А.в. С2-С4 — це гази, С5-С16 — рідини, а починаючи з С17 — тверді речовини.
Хімічні властивості А.в. зумовлені наявністю в їх структурі потрійного зв’язку. Ацетиленова (алкінна) група –С≡С–Н або –С≡С–R має лінійну будову, атоми карбону sp-гібридизовані. Вони зв’язані одним σ- та двома π-зв’язками, максимальні густини яких розташовані у двох взаємоперпендикулярних ділянках, утворюючи циліндричну хмару π-електронної густини. Відстань –С≡С– дорівнює 1,1205 нм, енергія потрійного зв’язку — 836 кДж/моль. Внаслідок особливостей будови потрійного зв’язку для алкінів характерні реакції приєднання, окиснення, полімеризації, ізомеризації та заміщення. А.в. приєднують за зв’язком –С≡С– галогени безпосередньо, галогеноводні — у присутності каталізаторів (напр. CuCl, HgCl2), утворюючи ди- і тетрагалогеніди. Реакції використовують у виробництві тетрахлоретилену, трихлоретилену, вінілхлориду та інших хлоропохідних сполук. Гідрогенізація А.в. натрієм у рідкому NH3 приводить до транс-алкенів, воднем над Pd/C — до цис-алкенів. Вода приєднується у присутності солей Hg2+ з утворенням ацетальдегіду для ацетилену і кетонів для всіх інших А.в. (реакція Кучерова). Пряма гідратація ацетилену можлива при пропусканні його в суміші з парами води при T=300–400 °С над фосфатами важких металів. Реакцію гідратації ацетилену застосовують у промисловості для добування ацетальдегіду і продуктів подальших його перетворень — оцтової кислоти, ацетону, спирту тощо. Спирти взаємодіють з А.в. у присутності ROH, BF3 або HgO, алкоксидів лужних металів, солей міді при T=150–200 °С:
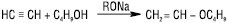
Продукти реакції — вінілові етери, які використовуються у виробництві полімерів, емульгаторів, мастильних матеріалів тощо. Аналогічно до А.в. приєднуються карбонові кислоти (каталізатор — HgSO4, ацетати Zn або Cd на активованому вугіллі), аміни, аміди кислот, тіоли та інші з утворенням вінілових сполук, напр.:
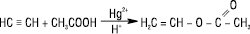
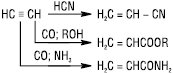
Вінілацетат широко застосовують для добування полімеру полівінілацетату (ПВА). Шляхом приєднання до ацетилену ціанідної кислоти чи при взаємодії його з СО і спиртами, NH3 або амінами у присутності Ni(СО)4 під тиском одержують нітрил, естери чи аміди акрилової кислоти, які використовуються в синтезі полімерів:
А.в. у присутності лужних каталізаторів приєднують альдегіди і кетони (реакція Фаворського):
Велике практичне значення має реакція взаємодії ацетилену з формальдегідом у присутності ацетиленіду Cu (реакція Реппе):
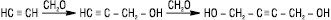
Пропаргіловий спирт (І) і 2-бутин-1,4-діол (ІІ) — вихідні сполуки у виробництві 1,4-бутиленгліколю. А.в. вступають у реакції циклоприєднання і Дільса — Альдера. Термічна чи каталітична полімеризація приводить до утворення олігомерів і полімерів. Напр. під впливом солей Cu (І) у водному HCl ацетилен димеризується у вінілацетилен, з якого одержують хлоропрен. Над активним вугіллям ацетилен тримеризується в бензол, у присутності Nі(CN)2 в тетрагідрофурані — в циклооктатетраєн (реакція Реппе), у присутності Н2 над Nі — в ізобутилен. З метилацетилену можна одержати мезитилен та ін. У присутності солей міді (І) та окисника ацетилен полімеризується з утворенням поліацетилену — карбіну, який вважається поряд з алмазом і графітом третьою алотропною видозміною вуглецю з кумульованою будовою макромолекул:
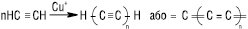
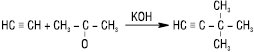
При дії лужних металів потрійний зв’язок в А.в. переміщується через стадію утворення проміжних аленів на кінець молекули. А у присутності спиртових розчинів лугу, навпаки, потрійний зв’язок переміщується до середини молекули:
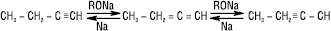
А.в. з кінцевими потрійними зв’язками (R–C≡CH) мають високу для вуглеводнів кислотність (для ацетилену рКа≈25) і утворюють при дії лужних, лужноземельних металів, амідів металів металічні похідні, так звані ацетиленіди МС≡СR, які енергійно реагують з водою, регенеруючи А.в. З магнійорганічними сполуками легко утворюються магнійгалогенопохідні А.в. (реактиви Іоцича). Ацетиленіди Mg, Na, Li використовують в органічному синтезі для введення в молекулу ацетиленової групи, напр.:
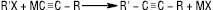
Дизаміщені ацетиленіди Cu2C2 і Ag2C2 утворюються при дії на ацетилен аміачних розчинів відповідних солей Cu(І) і Ag. Утворення Cu2C2 червоно-бурого кольору використовують для визначення ацетилену та його гомологів з кінцевим потрійним зв’язком. Ацетиленіди важких металів у сухому вигляді — нестійкі сполуки, які вибухають від струсу. При згорянні ацетилену в кисні виділяється велика кількість тепла (температура полум’я досягає 3000 °С), що дозволяє використовувати ацетилен для автогенного зварювання і різання металів. Окисники KMnO4 (в нейтральному чи лужному середовищі), K2Cr2O7, RuO4, SeO2, CrO3 у кислому середовищі, озон призводять до розщеплення потрійного зв’язку з утворенням карбонових кислот. У деяких випадках можливе окиснення до α-дикетонів. Алкіни з кінцевим потрійним зв’язком у цих умовах утворюють карбонову кислоту і СО2.
Методи добування ацетилену у промисловості:
1) розкладання карбіду кальцію водою:
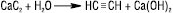
2) електрокрекінг природного газу (метану з домішками) в електродугових печах:
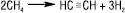
Температура 1600 °С, нормальний тиск, суміш газів різко охолоджують водою;
3) термоокиснювальний крекінг (часткове окиснення) природного газу завдяки теплу, яке виділяється при частковому згорянні метану:
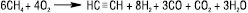
4) піроліз природного газу.
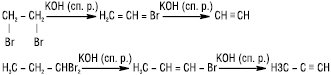
Одержують А.в. в лабораторних умовах в результаті дії спиртового лугу (КОН — спиртовий розчин) на 1,1- або 1,2-дигалогенопохідні вуглеводнів:
алкілуванням ацетиленідів натрію, електролізом двоосновних ненасичених кислот.
Алкіни, зокрема поліацетилени, виявлені у природі в багатьох рослинах, грибах (Basidiomycetes); напр. із соняшника виділено жовтий пентаїнен СН3–(С≡С)5–СН=СН2. А.в. виявляють наркотичну дію, яка посилюється із збільшенням молекулярної маси сполуки.
Тривалі контакти працівників із ацетиленом у виробничних умовах викликають функціональні порушення нервової системи. Його високі концентрації при незначному вмісті кисню призводять до втрати свідомості та набряку легень. Ацетилен — один із базових сировинних джерел промисловості органічного синтезу. При конденсації ацетилену з піролідоном одержують N-вінілпіролідон, який легко полімеризується з утворенням полівінілпіролідону (ПВП):
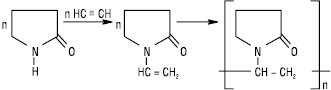
Полімерні сполуки на основі вінілпіролідону знайшли широке застосування в медичній практиці як речовини при виробництві ЛП, а багато з них самі є лікарськими. Напр. низькомолекулярний ПВП (12 000–13 000 мол. м.) утворює колоїдні розчини у воді й застосовується для приготування кровозамінника Гемодезу, середньомолекулярний ПВП (35 000–40 000) використовується у фармації як зв’язуюча речовина для виробництва таблеток.
При співполімеризації вінілпіролідону, акриламіду та етилкрилату одержують біорозчинний полімер, який забезпечує подовжену дію ЛП (пролонгуючий ефект), напр. лікарських плівок для очей.
Общая органическая химия. В 12 т. / Под общ. ред. Д. Бартона и У.Д. Оллиса. — Т. 3. Азотсодержащие соединения. — М., 1982; Черных В.П., Зименковский Б.С., Гриценко И.С. Органическая химия / Под общ. ред. В.П. Черных. — 2-е изд. — Х., 2007.
