ЕТИЛЕНІМІН (азиридин, дигідроазирин, диметиленамін, азациклопропан, мол. м. 43,01) — безбарвна рідина із запахом амоніаку; Tпл — 74 °С, Tкип — 57 °С; d420 0,832; nD25 1,4123; γ 0,3105 Н/м; рКа 7,88.
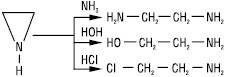
Добрерозчинний у воді та більшості органічних розчинників. У чистому стані Е. стійкий до нагрівання вище 150 °С, у водних розчинах легко гідролізується та полімеризується, особливо швидко у присутності кислот. Е. властиві реакції приєднання, що супроводжуються розкриттям циклу з амоніаком, амінами, галогеноводнями, водою:
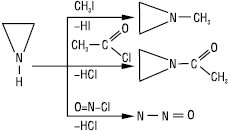
Етиленіміновий цикл легко розривається під дією кислот, тіокислот, сірководню, меркаптанів та тіосечовини. Е. вступає в реакцію полімеризації з утворенням поліетиленіміну. Також як вторинний амін Е. вступає в реакції алкілування, ацилювання, нітрозування тощо:
З карбонільними сполуками утворює стійкі N-етиленімінокарбіноли:
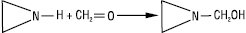 .
.
Наявність неподіленої пари електронів на атомі нітрогену зумовлює основні властивості Е. З металічним K і сплавом K–Na утворює металічні похідні (або солі). Для аналітичного визначення Е. використовують реакції розкриття циклу тіосульфатом, тіоціанатом або тіосечовиною, а також фотометрування забарвлених сполук Е., напр. з 3-(4-нітробензил)піридином.
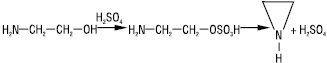
Отримують Е. з етаноламіну та сірчаної (сульфатної) кислоти з обробкою утвореного сульфатного естеру лугом (циклізація моноетаноламіну через 2-амніноетилсульфат за Венкером):
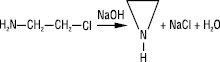
дією лугу на β-хлоретиламін:
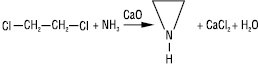
У промисловості — взаємодією 1,2-дихлоретану з амоніаком у присутності кальцію оксиду:
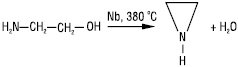
конверсією моноетаноламіну:
Е. входить до складу природних етиленіміновмісних антибіотиків (мітоміцинів А, В, С (I) та порфіроміцину):
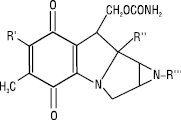
I
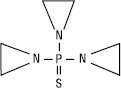
II
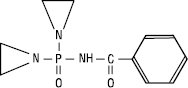
III
Похідні Е. за рахунок алкілувальної дії виявляють протипухлинну активність і є основою для виготовлення низки ЛП: тіофосфаміду (ІІ), бензотефу (ІІІ), фторбензотефу (цитостатична дія, пригнічує розвиток злоякісних новоутворень) та ін.
Е. використовують для отримання поліетиленіміну; обробки бавовняних та синтетичних волокон, які набувають здатності забарвлюватися кислими барвниками, та більшої стійкості та міцності (поліетиленімін як менш токсичний застосовують для підвищення міцності гуми і паперу, очищення стічних вод). Е. та його похідні — активні мутагени, широко застосовуються у селекції сільськогосподарських рослин і мікробіологічній селекції; рекомендовані як компоненти ракетного палива.
Е. є високотоксичною речовиною, викликає тяжкі отруєння; вияляє сильну подразнювальну дію. ГДК у повітрі становить 0,001 мг/м3.
Джилкрист Т. Химия гетероциклических соединений. — М., 1996; Иванов В.М. Гетероциклические азотсодержащие соединения. — М., 1982; Общая органическая химия. В 12 т. / Под ред. Д. Бартона и У.Д. Оллиса. — Т. 8. Азотсодержащие гетероциклы / Под ред. П.Г. Сэммса. — М., 1985; Пожарский А.Ф. Теоретические основы химии гетероциклов. — М., 1985 Черных В.П., Зименковский Б.С., Гриценко И.С. Органическая химия / Под общ. ред. В.П. Черных. — 2-е изд. — Х., 2007.
