НІТРАТИ — NO3–. Систематична назва — триоксонітрат (V)-іон. Н. розподіляються на Н. металів — солі нітратної кислоти та Н. органічні — похідні нітратної кислоти із загальною формулою R-ONO2 (етери, змішані ангідриди тощо). Н.-іон має будову плаского трикутника (ONO=120°, lNО=1,21Å), що зумовлено sp2-гібридизацією атомних орбіталей атома N та сильною делокалізацією його неподільної електронної пари. Графічно це зображається таким чином:
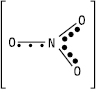
Н. металів досить стійкі за нормальних умов і легко кристалізуються, утворюючи кристалогідрати (крім лужних металів, Ag, Tl, Ba та Pb). Усі Н. елементарних катіонів добре розчиняються у воді (коефіцієнт їх розчинності здебільшого позитивний). Але деякі комплексні Н. важкорозчинні. Н. органічні, здебільшого малорозчинні у воді та добрерозчинні в органічних розчинниках. Н. Na+, K+ та Са2+ утворюють родовища мінералів, які називають селітрами (чилійська, індійська, норвезька тощо). Н. органічні входять до складу всіх рослин і тваринних організмів. Н. металів одержують дією HNO3 на метали, оксиди, деякі солі за реакцією обміну, дією NO2 на основи (у суміші з нітритами) або на солі. Н. органічні здебільшого отримують дією 100% HNO3, або нітруючої суміші на відповідні спирти за наявності малої кількості сечовини (для видалення HNO2):
ROH + HNO3 > RONO2 + H2O.
Також Н. органічні можуть бути одержані взаємодією AgNO3 з галогеналкілами, електролізом солей дикарбонових кислот за наявності KNO3 (NaNO3) та іншими методами.
Н. металів при підвищенні температури розкладаються з виділенням оксигену і виявляють сильні окисні властивості. При розкладанні Н. металів, розташованих у ряді напруг металів лівіше Mg, утворюються нітрити металів та кисень:
2KNO3 → 2KNO2 + O2.
А від Mg до Cu утворюють оксиди металів та кисень:
2Сu(NO3)2 → 2CuO + 4NO2 + O2.
При термічному розкладанні Н. неактивних металів утворюється вільний метал:
2AgNО3 → 2Ag + 2NO2 + O2.
У нейтральних і слабкокислих середовищах Н. металів майже не виявляють окисних властивостей. У сильнокислому середовищі Fe2+ відновлює Н.-іон до NO. Тількі активні метали відновлюють Н.-іон до NH3 у лужному середовищі (якісна реакція на нітрати). Але у розплавах Н. металів є сильними окисниками, напр., окиснюють Fe3+ до ферат-іонів:
Fe2O3 + 3KNO3 + 4KOH → 2K2FeO4 + + 3KNO2 + 2H2O.
Окисні властивості KNO3 застосовуються для виготовлення «чорного пороху»:
2KNO3 + 3C + S = N2 + 3CO2 + K2S.
Входження Н.-іонів до внутрішньої сфери комплексних сполук не є характерним, тому нітратні ацидокомплекси поширені тільки для деяких елементів (Th, La та його аналоги). Кристалогідрати Н. металів дуже гігроскопічні. Зневоднення кристалогідратів, утворених слабоосновними катіонами, супроводжується їх гідролізом. Н. органічні також гідролізуються з утворенням декількох похідних:
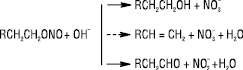
Дія концентрованих кислот на Н. органічні призводить до утворення відповідного спирту та нітроній-катіонів:
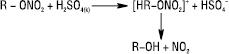
Н. органічні термічно нестійкі, деякі з них при перегріванні парів вибухають. Схильність до вибуху підвищується зі збільшенням ONO2-груп. Вони є енергійними окисниками.
Н. металів широко використовують у виробництві ЛП, як добрива, у виробництві вибухівки, як протраву при фарбуванні тканин. Н. органічні також використовують при різноманітних синтезах азотвмісних сполук, які мають біологічно активні властивості.
Н. мають антиангінальні та судинорозширювальні властивості. Це зумовлено їх сильною окиснювальною здатністю. Вони регулюють співвідношення окиснених та відновлених форм нікотинамідних ферментів і деяких дегідрогеназ, що впливає на судинний тонус та діяльність серця. Судинорозширювальний ефект пов’язаний з пригніченням судинорухового центру з безпосереднім впливом на стінки судин. Розширення судин супроводжується зниженням АТ та рефлекторним підвищенням ЧСС, зменшенням потреби міокарда в кисні. Таким чином, Н. виявляють ще й холінолітичні (антихолінергічні) властивості.
У фармації використовують як Н. металів (здебільшого NaNO3), так і Н. органічні NaNO3, як судинорозширювальну речовину (з ефектом зниження АТ). Н. органічні (метилнітрат, етилнітрат, амілнітрат, нітрогліцерин, нітрати целюлози та ін.) входять до складу препаратів, які мають судинорозширювальну та спазмолітичну дію (Нітрогліцерин, Сустак тощо). У високих дозах Н. токсичнi. Вони окиснюють гемоглобін до метгемоглобіну, що викликає порушення постачання організму киснем з тяжкими наслідками.
Краткая химическая энциклопедия. — М., 1988; Миниович М.А. Соли азотной кислоты (Нитраты). — М., 1946; Суховєєв В.В., Сенченко Г.Г., Ковтун Г.О., Приплавко С.О. Металовмісні лікарські препарати. — К., 2000; Чекман И.С., Пелещук А.П., Пятак О.А. и др. Справочник по клинической фармокологии и фармакотерапии. — К., 1987.
