ПЕПТИДИ (грец. peptos — перетравлений) — органічні сполуки, які утворюються внаслідок поліконденсації амінокислот, тобто взаємодії їх α-карбоксильної та α-аміногруп. Довжина пептидного ланцюга в П. і білках може коливатися у широких межах — від 2 до 100, а іноді до тисячі амінокислотних залишків. Умовно всі П. залежно від довжини ланцюга розділяють на олігопептиди (містять 2–10 амінокислот), поліпептиди (10–50) та білки (>50). Якщо середньою мол. м. амінокислоти вважати 100 Дал, то мол. м. П. буде знаходитися у межах 200–1000 Да, поліпептидів — 1000–4000, а білків — від 4–5 тис. до декількох мільйонів. Молекули П. можуть бути лінійними або циклічними. На одному з кінців лінійні П. містять вільну карбоксильну (С-кінець), а на другому — вільну аміногрупу (N-кінець):
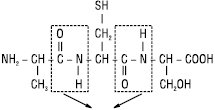
Пептидні зв'язки у трипептиді
Назви П. утворюються з назв залишків амінокислот, які входять до їх складу, починаючи з N-кінцевої амінокислоти. Причому в назвах амінокислот, карбоксильні групи яких беруть участь у реакції поліконденсації й руйнуються, утворюючи ацильні залишки, суфікс «ін» змінюється на «іл». Наведений трипептид має назву аланіл-цистеїл-серин. Низькомолекулярні П. за властивостями відрізняються від білків — для них нехарактерні денатурація та ефект Тіндаля. Залежно від амінокислотного складу П. бувають кислими, лужними, нейтральними і мають у дисоційованій формі позитивний, негативний та нульовий заряди. В організмі П. можуть синтезуватися з амінокислот або утворюватися при ферментативному гідролізі білків. У тканинах та рідинах організму міститься велика кількість біологічно активних П. Кількість амінокислотних залишків у структурі біологічно активних П. коливається в середньому від 3 до 50. До найменших П. можна віднести тиреотропін-рилізинг-гормон та глутатіон (трипептиди), а також енкефаліни, які складаються з 5 амінокислот. Однак більшість біологічно активних П. має більше 10 амінокислот, напр., нейропептид ψ (регулятор апетиту) містить 36 амінокислот, а кортиколіберин — 41 амінокислоту. У деяких біологічно активних П. існують незвичайні зв’язки між амінокислотами, які не зустрічаються в білках. Напр. П., які містять незвичайний для білків зв’язок між амінокислотами трипептид глутатіон, побудований з глутамату, цистеїну та гліцину. N-кінцева глутамінова кислота зв’язана з іншою амінокислотою не через α-, а через γ-карбоксильну групу бокового радикалу. Глутатіон — широко розповсюджений П. організму людини. Він може бути використаний в окиснювально-відновних реакціях як донор та акцептор гідрогену, необхідний для активності ряду ферментів. Функції П. залежать від їх первинної структури. Ангіотензин І за структурою дуже схожий на ангіотензин ІІ (має тільки дві додаткові амінокислоти з С-кінця), але при цьому не має біологічної активності. Зміни в амінокислотному складі П. часто призводять до втрати одних та виникнення інших біологічних властивостей.
П. — потужні регулятори біологічних процесів. Їх можна використовувати як ЛП. Основна перешкода для їх терапевтичного використання — швидке руйнування в організмі. Одним з найважливіших завдань досліджень П. є не тільки вивчення їх структури, а й одержання синтетичних аналогів природних П. з цілеспрямованими змінами в їх структурі та функціях. Напр., синтезований пептид 1-дезаміно-8-D-аргінін-вазопресин (ДАВ), у структурі якого (порівняно з вазопресином) немає аміногрупи на N-кінці та замість L-аргініну в положенні 8 знаходиться D-аргінін. Такому синтетичному П. властива тільки антидіуретична активність та хімічна стійкість, що забезпечує при введенні в організм пролонговану дію. Цей штучний аналог гормону (порівняно з природним) більш ефективний при лікуванні гормональної недостатності.
П. можна розподілити на групи за їх основною біологічною дією: П., яким властива гормональна активність (окситоцин, вазопресин, рилізинг-гормони гіпоталамусу, меланоцитстимулювальний гормон, глюкагон та ін.); П., що регулюють процеси травлення (гастрин, холецистокінін, вазоінтестинальний пептид, шлунковий інгібуючий пептид та ін.); П., що регулюють тонус судин та АТ (брадикінін, калінін, ангіотензин ІІ); П., які регулюють апетит (лептин, нейропептид ψ, меланоцитстимулювальний гормон, β-ендорфіни); П., яким властива знеболювальна дія (енкефаліни, ендорфіни та інші опіоїдні П.). Їх знеболювальна активність у сотні разів перевищує анальгезивний ефект морфіну; П., що беруть участь у регуляції вищої нервової діяльності, в біохімічних процесах, пов’язаних з механізмами сну, навчання, пам’яті, утворення почуття страху та ін.
Такий розподіл П. є умовним. Існують дані про те, що багато П. мають широкий спектр дії. Так, меланоцитстимулювальний гормон, окрім стимуляції пігментоутворення, бере участь у регулюванні апетиту (разом з лептином пригнічує споживання їжі та є антагоністом нейропептиду ψ). Так, β-ендорфіни, крім анальгезивного ефекту, виконують функції синергіста нейропептиду ψ, тобто посилюють ефект споживання їжі. Вазопресин, окрім антидіуретичної та судинозвужувальної дії, має властивість покращувати пам’ять. Серед П. зустрічаються циклопептиди, яким властива токсична (фалоїдин, аманітин) та антибактеріальна дія. У лабораторних умовах П. одержують неповним гідролізом білків, а біологічно активні форми синтезують з амінокислот.
Біологічна хімія / Л.М. Вороніна, В.Ф. Десенко, Н.М. Мадієвська та ін. — Х., 2000; Биохимия / Под ред. Е.С. Северина. — М., 2003; Боєчко Ф.Ф., Боєчко Л.О. Основні біохімічні поняття, визначення і терміни. — К., 1993; Гонський Я.І., Максимчук Т.П. Біохімія людини. — Тернопіль, 2001; Губський Ю.І. Біологічна хімія. — К.–Тернопіль, 2000.
