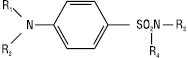
Сульфаніламіди. До сульфаніламідів належить група хіміотерапевтичних ЛП бактеріостатичної дії, похідних 4-амінобензолсульфаміду загальної формули:
 ,
,
де R1=R2=гідроген; R1=гідроген, R2=ацил, напр. залишок фталевої кислоти або метансульфонат натрію; R1=R2=залишок азогрупи; R4=гідроген, лужний (натрій) або важкий (аргентум) метал; R3=гідроген, гетероцикл, ацетил, залишок сечовини або гуанідину.
Наприкінці XIX ст. в ході робіт з пошуку барвників з метою вибіркового фарбування мікроорганізмів для мікроскопії П. Ерліх встановив, що деякі з них не тільки забарвлюють мікроорганізми, але й викликають їх загибель. У 1908 р. Гельмо синтезував п-амінобензолсульфамід, який широко застосовують як основу для багатьох азобарвників у текстильній промисловості. У 1932 р. Герхард Домагк синтезував азобарвник — сульфамідохризоїдин
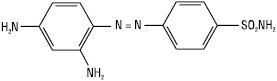
і встановив, що він запобігає загибелі білих мишей, заражених смертельною дозою гемолітичного стрептокока. У 1934 р. Домагк уперше опублікував свої клінічні спостереження про високу терапевтичну активність сульфамідохризоїдину (Пронтозилу) при тяжких стрептококових інфекціях — бешисі та пологовому сепсисі. Поряд із синтезом і клінічними дослідженнями в перші ж роки появи С. почалися глибокі біохімічні дослідження, які ставили своєю метою вивчення механізму їх дії на бактерійну клітину. У 1935 р. співробітники інституту Л. Пастера встановили, що Пронтозил в організмі тварини розщеплюється з утворенням двох продуктів: С. (І) (речовина з високою терапевтичною активністю) та 1,2,4-триамінобензолу (ІІ) (токсичний, неактивний проти бактерій продукт):
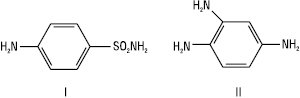 .
.
Це відкриття змусило відмовитися від діазотованих сполук типу Пронтозилу, а всю увагу зосередити на дослідженні С. та його похідних. Було синтезовано понад 20 000 сполук, похідних С., серед яких лише незначна частина використовується в медичній практиці. Одночасно із синтезом БАР — похідних С., проводилися роботи зі встановлення зв’язку між їх хімічною будовою і фізіологічною дією, які дозволили зробити такі висновки: для того, щоб сполука мала антибактеріальну активність, необхідна наявність у молекулі сульфанільного радикала:
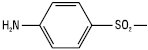
Ця частина молекули є основою для отримання фізіологічного ефекту. Якщо аміногрупу в положенні 4 або атом гідрогену в аміногрупі замінити такими радикалами, при наявності яких в організмі не може знову утворитися вільна аміногрупа, така сполука не матиме антибактеріальної активності. Переміщення аміногрупи з положення 4 в положення 2 або 3 бензольного ядра призводить до повної втрати активності. Введення в бензольне ядро додаткових радикалів припиняє активність сполуки або значно знижує її. При заміщенні гідрогену сульфамідної групи різноманітними радикалами — фізіологічна активність підвищується або знижується залежно від характеру введеного радикала.
Серед теорій, які пояснюють механізм дії лікарських сполук, похідних С., загальноприйнятою є теорія, яка ґрунтується на відкритій англійським ученим Вудсом антагоністичній дії С. на низку продуктів, що містять залишок п-амінобензойної кислоти (ПАБК).
С., що є похідними аміду сульфанілової кислоти, мають однаковий спектр антимікробної дії і відрізняються такими фармакокінетичними параметрами, як усмоктуваність у ШКТ і тривалість дії.
За всмоктуваністю в ШКТ розрізняють С., які добре всмоктуються при пероральному застосуванні, та С., які погано всмоктуються. Перші проявляють резорбтивну дію (сульфадимедин, сульфацетамід, сульфаетідол, сульфадиметоксин, сульфаметоксипіридазин, уросульфан тощо). За тривалістю дії С. системної дії поділяють на: препарати короткої дії — до 8 год (сульфадимедин, сульфаетидол, уросульфан, сульфацетамід та ін.); препарати середньої тривалості дії — 8–16 год (сульфадіазин, сульфаметоксазол, сульфаметрол); препарати тривалої дії — 24–48 год (сульфадиметоксин, сульфаметоксипіридазин, сульфамонометоксин); препарати надтривалої дії — понад 48 год (сульфален). Препарати, які погано всмоктуються в ШКТ, проявляють дію в просвіті кишечнику (фталілсульфазол, сульфагуанідин). Крім того, виділяються С. для місцевого застосування. Це, перш за все, добрерозчинні натрієві солі сульфаніламідів (сульфацетамід, сульфаметоксипіридазин). До окремої групи відносять С. для зовнішнього застосування: срібні солі (сульфазин срібла, сульфадіазин срібла, сульфатіазол срібла) і ацетати С. (мафенід). У медичній практиці широко використовують також комбіновані препарати з триметопримом (ко-тримоксазол, лідаприм, сульфатон, потесептил, дитрим, потесета), а також із саліциловою кислотою (салазодин, салазометоксин, салазосульфапіридин).
Сучасні С. характеризуються спільним спектром і механізмом протимікробної дії. Останній ґрунтується на конкурентному антагонізмі С. і ПАБК як подібних за структурою й властивостями речовин. Вплив С. і ПАБК на життєдіяльність мікроорганізмів прямо протилежний. ПАБК у мікроорганізмах перетворюється на дигідрофолієву, а потім на тетрагідрофолієву кислоту. Остання бере участь у синтезі пуринів, піримідинів і нуклеїнових кислот. Ці продукти вкрай необхідні для синтезу білків, ферментів, розвитку і розмноження мікроорганізмів. Виникає дефіцит ПАБК у бактеріальних клітинах, оскільки сульфаніламіди надходять в їх протоплазму тими ж транспортними шляхами, що і ПАБК. У зв’язку з цим різко зменшується кількість вільних переносників ПАБК, як і їх рецепторів у протоплазмі збудників. Крім того, сульфаніламіди конкурують з ПАБК за активний центр дигідроптероатсинтетази — ферменту, який забезпечує перетворення ПАБК і птеридину на фолієву кислоту. Утворюються неактивні аналоги фолієвої кислоти. Усе це негативно відбивається на синтезі пуринів, піримідинів і нуклеїнових кислот, рості та розмноженні збудників. Нормальна біосинтетична реакція:
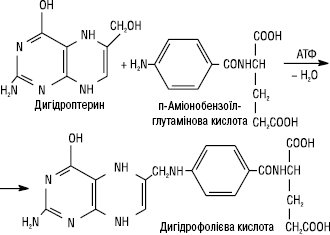
Конкурентна реакція:
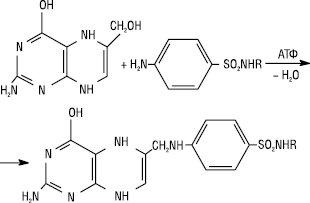
Через меншу спорідненість рецепторів і мікробних ферментів із сульфаніламідами, ніж з ПАБК, лікувальний ефект досягається лише тоді, коли їх концентрація в крові й тканинах хворих людей значно перевищує концентрацію ПАБК. Тому при гнійних процесах ефективність С. знижується. Необхідно враховувати, що деякі лікарські сполуки, в молекулу яких входить залишок ПАБК (напр. прокаїн), можуть виявляти виразну антисульфаніламідну дію. Резистентність до С. розвивається у зв’язку з мутацією мікробних клітин. Це може проявлятися накопиченням надмірної кількості ПАБК, змінами структури і властивостей відповідних бактерійних ферментів або втратою проникності мембран збудників для С. Більшість С. проявляють бактеріостатичну дію; С. комбіновані з триметопримом — бактерицидну дію, тому що триметоприм пригнічує дигідрофолатредуктазу і виникає подвійний метаболічний блок.
С. належать до хіміотерапевтичних препаратів широкого спектра дії. Найчутливішими до них виявилися: бактерії — стрептококи, стафілококи, пневмококи, менінгококи, гонококи, кишкова паличка, сальмонели, холерний вібріон, паличка сибірки, гемолітична паличка; хламідії — збудники трахоми, пситакозу, пахового лімфогранулематозу; найпростіші — малярійний плазмодій, токсоплазми; патогенні гриби — актиноміцети, кокцидії, гістоплазми. Помірно чутливими мікроорганізмами є: бактерії — ентерококи, мікобактерії лепри, зеленящий стрептокок; протеус, бруцели, клебсієли, клостридії; пастерели, францисели; найпростіші — лейшманії. С. також стимулюють синтез глюкокортикоїдів, унаслідок чого пригнічується міграція лімфоїдних клітин, проявляються протизапальний і антиалергічний ефекти, але гальмуються процеси регенерації, особливо при місцевому застосуванні. С. мають жарознижувальні властивості, пригнічують теплопродукцію, знижують аутоінтоксикацію, яка зазвичай виникає при тканинному розпаді; проявляють також гіпоглікемічну, імунокоригувальну (салазодин, салазосульфапіридин) дію.
Для ідентифікації С. застосовують фізичні й фізико-хімічні методи аналізу, такі як визначення Тпл, ІЧ-спектрофотометрію, хроматографію в тонкому шарі сорбенту. С., які мають відкриту первинну ароматичну аміногрупу, дають реакцію діазотування і азосполучення. Кислотні властивості сульфамідної групи зумовлюють реакцію з солями важких металів. У слабколужному середовищі утворюються забарвлені осади комплексних солей. Для ідентифікації С. використовують також реакцію утворення забарвленого плаву при обережному піролізі речовини. У деяких випадках при цьому з’являється специфічний запах. Кількісне визначення С., які мають відкриту первинну ароматичну аміногрупу, проводять методом нітритометрії. Застосовують також методи алкаліметрії в неводному середовищі, аргентометрії, броматометрії.
Беликов В.Г. Фармацевтическая химия: В 2 ч. — Ч. 1. Общая фармацевтическая химия. — М., 1993; Беликов В.Г. Фармацевтическая химия: В 2 ч. — Ч. 2. Общая фармацевтическая химия. — Пятигорск, 1996; Машковский М.Д. Лекарственные средства: В 2 т. — М., 2001. — Т. 1, 2; Методы анализа лекарств / Н.П. Максютина, Ф.Е. Каган, Л.А. Кириченко и др. — К., 1984; Скакун М.П., Посохова К.А. Фармакологія. — Тернопіль, 2002; Харкевич Д.А. Фармакология. — М., 1999.
