ДИПОЛЬНИЙ МОМЕНТ (ЕЛЕКТРИЧНИЙ) — це векторна величина, яка характеризує асиметрію розподілу позитивного та негативного зарядів в електрично нейтральній системі. Д.м. використовується при структурних дослідженнях молекул, встановлення конформації, конформаційного та ізомерного складу сполуки, його залежність від температури. Величини Д.м. молекул дозволяють судити про розподіл електронної густини в молекулах та залежність цього розподілу від характеру окремих замісників.
Залежно від характеру розподілу електронної густини молекули поділяють на полярні та неполярні. У неполярних молекулах централи тяжіння позитивних і негативних зарядів збігаються. Полярні молекули — диполь, тобто системи, в яких рівні за величиною і протилежні за знаком заряди (+q та –q) знаходяться на деякій відстані l один від одного. Відстань між центрами тяжіння позитивного та негативного зарядів називають довжиною диполя. При утворенні хімічного зв’язку між атомами з різною електронегативністю електронні хмари зміщуються до атомів з більшою електронегативністю і зв’язок стає полярним. Полярність молекули, як і полярність зв’язку, кількісно оцінюють величиною електричного моменту диполя µ, який є добутком абсолютного значення заряду електрона q на відстань l між центрами позитивного та негативного зарядів у молекулі.
µ = q · l.
Довжина диполя l набуває значення, близького до діаметра атома 10–10 м, а заряд q дорівнює заряду електрона 1,6 · 10–19 Кл. Електричний момент диполя таким чином має розмірність Кл · м. Його інколи виражають у диполях і позначають Д:
1 Д=3,33 · 10–30 Кл · м.
Значення Д.м. ковалентних молекул — у межах 0–4 Д, іонних — 4–11 Д.
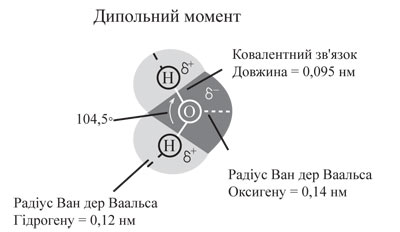
У багатоатомній молекулі електричний момент диполя дорівнює сумі Д.м. усіх зв’язків і незв’язуючих електронних хмар (Д.м. є вектором, направленим від позитивного до негативного полюса). Величина сумарного Д.м. залежить від геометрії молекули. Так, молекула АВ2 неполярна, якщо має лінійну будову: молекула СО2 за рахунок sp-гібридизації орбіталей атома карбону має симетричну лінійну будову Оδ–=С2δ+=Оδ–, хоча зв’язки =С=О сильно полярні (μ = 2,7 Д), унаслідок компенсації їх дипольних моментів, молекула карбон (IV) оксиду неполярна (μ = 0). Навпаки, у молекулі води Н2О полярні зв’язки –О–Н розміщені під кутом 104,5°, їх Д.м. взаємно не компенсуються, тому молекула є полярною:
μ = 1,84 Д або 0,61· 10–29 Кл · м.
Розрізняють миттєві та індуковані диполі зв’язків і молекул. Молекула — це динамічна система, розподіл електронної густини в якій не може бути постійним. Так, молекули галогенів неполярні (μ = 0). Однак у такій молекулі весь час відбувається зміщення електронної густини, а отже, зарядів, до одного із атомів галогену Clδ+ — Clδ-або Clδ- — Clδ+, при цьому утворюються миттєві мікродиполі. Оскільки зміщення зарядів до обох атомів однаково ймовірно, то середній розподіл зарядів залишається постійним (μ = 0). Під дією зовнішнього електричного поля в молекулі відбувається перерозподіл зарядів, на атомах виникає диполь, який називають наведеним або індукованим. На відміну від постійних і миттєвих, наведені диполі існують лише при дії зовнішнього електричного поля.
Існує декілька методів визначення електричного Д.м. Спектроскопічні методи визначення Д.м. молекул засновані на ефектах розщеплення та зсуві спектральних смуг в електричному полі (ефект Штарка). Цей метод дає найточніші значення величини Д.м. (до 10–4 Д), причому експериментально визначається не тільки величина, але й направленість вектора Д.м. Важливо, що точність визначення Д.м. не залежить від його абсолютної величини. Це дозволило отримати точні значення дуже малих Д.м. ряду молекул вуглеводнів, які неможливо надійно визначити іншими методами. Так, Д.м. пропану дорівнює 0,085±0,001 Д, пропілену 0,364±0,001 Д, толуолу 0,375±0,01 Д, азулену 0,796±0,01 Д. Галузь застосування методу мікрохвильової спектроскопії обмежена тільки невеликими молекулами, які не містять атомів важких елементів.
Інша група методів визначення Д.м. заснована на визначенні діелектричної проникності сполуки. За цими методами визначені Д.м. молекул понад 10 тис. сполук.
На основі експериментальних значень дипольного моменту обчислюють полярність та поляризованість зв’язку й ефективні заряди їх атомів. Значення електричного Д.м. молекул розчинників дозволяє передбачити розчинність речовин, особливо солей. Так, вода добре розчиняє солі, оскільки її молекули полярні та мають велике значення електричного Д.м.
Ахметов Н.С. Общая и неорганическая химия. 4-е изд., испр. — М., 2001; Ландау Л.Д., Лифшиц Е.М. Теория поля. — М., 1988.
