ГРАНИЧНИЙ ВМІСТ ДОМІШОК — метод регламентованого контролю неспецифічних домішок, здебільшого неорганічних катіонів і аніонів у лікарських субстанціях (ДФУ). Вибір контрольованих катіонів і аніонів обґрунтовується технологічним процесом. Зазначаються також і межі їх вмісту. Контроль катіонів та аніонів, що входять до складу діючої речовини, не здійснюють. Коцентрацію розчинів або кількість речовини для випробувань зазначають у монографії на лікарську субстанцію. Результат методу випробування на домішки оцінюють порівняно з еталонними розчинами, наведеними у ДФУ. Для визначення неорганічних катіонів та аніонів ДФУ зазначає такі методи.
Амонію солі визначають: 1) за утворенням жовтого забарвлення при реакції з лужним розчином калію тетрайодомеркурату (методи А, В, С). Умови визначення — лужне середовище. Метод А засосовують, коли немає інших зазначень в окремій статті. Метод В — для зразків, що містять лужноземельні та важкі метали (попереднє осадження останніх розчинами гідроксиду та карбонату натрію). Метод С — для зразків, що містять понад 300 ррт (відповідно до ДФУ — частина на мільйон) домішки заліза (попереднє зв’язування калію-натрію тартратом у комплексну сполуку);
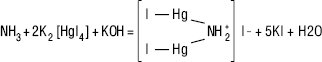
2) за допомогою реакції взаємодії аміаку, що виділяється під дією магнію оксиду важкого, із срібно-марганцевим папером з утворенням бурої плями за рахунок утворення металевого срібла та оксиду марганцю (метод В).
2AgNO3+MnSO4+4NH3+2H2O = 2Ag↓+MnO2↓+(NH4)2SO4+NH4NO3.
Умови визначення — витримування реакційної суміші при 40 °С протягом 30 хв.
Арсен визначається тоді, коли вихідна сировина забруднена арсеном або коли можливе забруднення ним під час технологічного процесу. Визначення за методом А ґрунтується на відновленні сполук арсену металевим цинком в кислому середовищі до арсену, який утворює забарвлену пляму на ртутно-бромідному папері.
6Zn +As2O +12HCl = 2AsH3↑+ 3H2O + 6ZnCl2
AsH3 + HgBr2 = AsH2(HgBr) + HCl;
AsH3 + 2HgBr2 = AsH(HgBr)2 + 2HBr;
AsH3 + 3HgBr2 = As(HgBr)3 + 3HBr;
AsH3+ As(HgBr)3 = As2Hg3↓ + 3HBr.
Умови визначення — спеціальний прилад (ДФУ), витримування реакційної суміші при температурі не вищій за 40 °С протягом 2 год, кисле середовище; допоміжні реактиви — розчин олова хлориду, розчин калію йодиду, свинцевоацетатна вата чи папір. Метод В застосовують у разі визначення поряд з арсеном селену і телуру, а також при визначенні арсену в зразках, які містять сурму, вісмут, ртуть і срібло, а також сульфіди та сульфіти. В основі методу — відновлення сполук арсену до вільного під дією реактиву гіпофосфіту в кислому середовищі:
NaH2PO2+ HCl = H3PO2+NaCl
As2O3 + 3H3PO2 = 2As↓ + 3H3PO3. As2O5 + 5H3PO2 = 2As↓ + 5H3PO3.
Умови визначення — нагрівання на водяній бані протягом 15 хв.
Кальцій визначають реакцією з амонію оксалатом в присутності оцтової кислоти. Умови визначення — додавання до випробовуваного розчину еталонного розчину кальцію спиртового.
Ca2+ + C2O42- = CaC2O4↓.
Хлориди визначають за утворенням білої опалесценції в результаті реакції з нітратом срібла в присутності азотної кислоти.
Cl– + Ag+ = AgCl↓.
Визначення фторидів базується на здатності солей кремнефтористоводневої кислоти, що утворюється при взаємодії фторидів із піском при нагріванні в кислому середовищі, взаємодіяти з комплексною церієвою сіллю амінометилалізариндіоцтової кислоти (I).
SiO2 + 6HF → H2[SiF6]↑ + 2H2O. H2[SiF6] + 2NaOH → Na2[SiF6] + 2H2O.
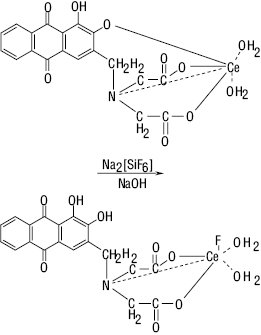
При цьому відбувається зміна забарвлення з червоного на синє. Умови визначення — спеціальний прилад (ДФУ), нагрівання до 146 °С, допоміжний реактив — натрію гідроксид.
Магній визначають, ґрунтуючись на його здатності утворювати при рН 10,5–11,5 жовто-зелене забарвлення хлороформного розчину гідроксихіноліну. Умови визначення — попереднє відділення комлексних сполук гідроксихіноліну з іншими катіонами в хлороформі при рН 8,8–9,2, допоміжні реактиви — динатрію тетраборат, бутиламін, триетаноламін (II).
Магній і лужноземельні метали визначають комплексометричним титруванням цинку сульфату та випробовуваного розчину розчином натрію едетату в присутності індикаторної суміші протравного чорного. Умови визначення — нагрівання до 40 °С, допоміжні реактиви — гідроксиламіну гідрохлорид, аміачний буферний розчин рН 10,0. У цьому випробуванні еталонний розчин не застосовують. Кількість титранту визначається в окремій статті.
Важкі метали визначають за допомогою тіоацетамідного реактиву в присутності буферного розчину рН 3,5.
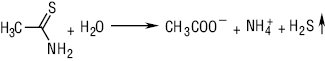
Сірководень, що виділяється, утворює коричневе забарвлення при взаємодії з важкими металами. Pb2+ + S2- = PbS↓. Методи визначення домішки важких металів, наведені в ДФУ (А–F), відрізняються підготовкою випробовуваної речовини залежно від її властивостей. Метод, за яким слід проводити визначення, зазначено в окремій статті. Якщо відсутні інші зазначення в окремій статті, вміст важких металів не має перевищувати 0,001%.
Залізо визначають за утворенням рожевого забарвлення при взаємодії з лимонною та тіогліколевою кислотами з подальшим підлуженням розчином аміаку.
Фосфати визначають за утворенням синього забарвлення у реакції з сульфомолібденовим реактивом. Допоміжний реактив — олова (ІІ) хлорид.
Калій визначають за утворенням опалесценції при взаємодії з натрію тетрафенілборатом.
K+ + В–(C6H5)4 → KB(C6H5)4↓.
Визначення сульфатів ґрунтується на їх здатності утворювати білий осад при взаємодії з барію хлоридом. Умови визначення — додавання еталонного розчину сульфату для підвищення концентрації, допоміжний реактив — оцтова кислота. Ba2+ + SО42- = BaSO4↓
Алюміній визначають за реакцією з гідроксихіноліном у хлороформі. Кількість домішки контролюють флуориметрично порівняно з еталоном (III).
Цинк визначають за утворенням білої опалесценції при взаємодії з калію фероціанідом у кислому середовищі
3Zn2++2K++2[Fe(CN)6]4- = K2Zn3[Fe(CN)6]2↓.
Сульфатна зола та загальна зола характеризують загальну мінералізацію субстанції. Визначення проводять спалюванням речовини до постійної маси при 600 °С у присутності сірчаної кислоти (сульфатна зола) чи без додавання реактивів (загальна зола). Як правило, загальна чи сульфатна зола не перевищує 0,1%. Відсутність цього випробування чи підвищений вміст золи вимагає обґрунтування.
Речовини, що легко обвуглюються, визначаються з концентрованою сульфатною кислотою з подальшою оцінкою забарвлення отриманого розчину. Випробування є неспецифічним тестом на органічні домішки.
Крім загальних методик визначення неорганічних катіонів та аніонів, регламентується визначення свинцю у цукрах та нікелю в поліолах та гідрогенізованих рослинних оліях методом атомно-абсорбційної спектрометрії, домішок у жирних оліях (стерини, антиоксиданти, лужні та сторонні домішки) методами тонкошарової та газової хроматографії; залишкових кількостей етиленоксиду, N,N-диметиланіліну, 2-етилгексанової кислоти методом газової хроматографії. Також наведені методики визначення сульфатної золи, загальної золи та речовин, що легко обвуглюються.
ДФУ. — Х., 2001.
