АМІДИ КАРБОНОВИХ КИСЛОТ — функціональні похідні карбонових кислот, у молекулах яких гідроксильна група карбоксилу заміщена на аміногрупу.
У багатьох випадках для назв А.к.к. використовують тривіальні назви кислотних залишків — ацилів, замінюючи в них суфікс —ил(-іл) на —амід. За замісною номенклатурою IUPAC назви А.к.к. утворюють із назв кислот, замінюючи суфікс —ова та слово кислота на суфікс —амід: НСОNH2 — амід мурашиної кислоти, формамід; СН3СОNH2 — амід оцтової кислоти, ацетамід; С6Н5СОNH2 — амід бензойної кислоти, бензамід. Ацетамід — рідина, інші А.к.к. — кристалічні речовини. Фізичні властивості деяких А.к.к. наведені в таблиці.
Таблиця. Властивості
| Назва | Формула | tпл, °С | tкип, °С | d4t |
| Формамід | НСОNН2 | 2,5 | 210,7 | 1,133 (20 °С) |
| Ацетамід | СН3СОNH2 | 82,0–83,0 | 221,2 | 1,159 (20 °С) |
| Пропіоамід | СН3СН2СОNH2 | 81,3 | 213 | – |
| Акриламід | СН2=СНСОNH2 | 84,5 | 215 | 1,22 (30 °С) |
| Бензамід | С6Н5СОNH2 | 130,0 | 288,0–290,0 | 1,341 (4 °С) |
| Нікотинамід | 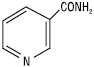 |
128,0–131,0 | – | – |
А.к.к. — нейтральні сполуки, які виявляють амфотерні властивості. Нейтральний характер амідогрупи в А.к.к. зумовлений спряженням неподіленої пари електронів нітрогену з подвійним зв’язком карбонільної групи (р, π-):
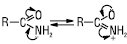
Із сильними мінеральними кислотами вони утворюють солі, які дуже легко гідролізуються. У катіоні солей А.к.к. протон зв’язаний з оксигеном карбонільної групи:
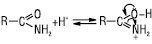
У заміщених А.к.к.
(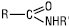 ;
;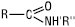 )
)
основні властивості більш виражені. Диметилацетамід утворює сіль із концентрованою HCl, стійку у водних розчинах, а також стійкі солі з HClO4 та H2PtCl6. При обробці А.к.к. металічним натрієм у безводному середовищі (напр. у рідкому NH3) або NaNH2 один з атомів гідрогену амідної групи заміщується металом, утворюючи солі, які миттєво розкладаються водою, регенеруючи амід:
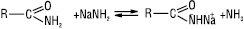
Порівняно з іншими похідними карбонових кислот А.к.к. найменш схильні до реакцій нуклеофільного заміщення. Гідроліз А.к.к. проходить у досить жорстких умовах (тривале кип’ятіння в середовищі кислот або лугів):

Нагрівання незаміщених А.к.к. з дегідратаційними реагентами призводить до утворення нітрилів:
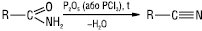
Незаміщені А.к.к. розщеплюються до первинних амінів під дією гіпобромітів та гіпохлоритів у лужному середовищі (перегрупування Гофмана):
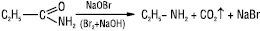
У результаті відновлення утворюються аміни:
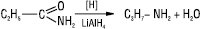
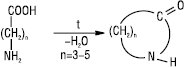
Промислове значення мають реакції заміщення гідрогену групи –NH2 на галоген у присутності основ з утворенням галогенамідів RCONHCl. Нестійкі N-галогенаміди використовують як галогенуючі агенти. А.к.к. синтезують у промислових умовах при взаємодії галогенангідридів, ангідридів, естерів карбонових кислот з NH3 (амоноліз), первинними чи вторинними амінами (аміноліз), гідролізом нітрилів; дегідратацією амонійних солей (T 220 °С) при одночасному введенні газоподібного амоніаку. Циклічні аміди (лактами) утворюються в результаті нагрівання амінокислот:
Амідна група — NНСО відіграє основну роль в утворенні молекул поліпептидів (до яких належать багато антибіотиків), білків, поліамідних волокон.
А.к.к. використовують як проміжні продукти в синтезі сульфаніламідних препаратів, барвників. Деякі А.к.к. застосовують як розчинники у промисловості, у т.ч. фармацевтичній (ДМФА для очищення гідрокортизону ацетату, дигідрострептоміцину). Лактами як БАС входять до складу лактамних антибіотиків (β-лактами), водний розчин полі-N-вінілпіролідону — відомий замінник плазми крові. А.к.к. застосовують у виробництві поліамідних волокон, як антиозонанти — для каучуків, як пластифікатори, екстрагенти, сировину для хімічної промисловості. В аналітичній практиці за властивостями А.к.к. ідентифікують відповідні карбонові кислоти.
Карбоновые кислоты и их производные. Соединения фосфора / Под ред. О.И. Сазерленда. — М., 1983; Общая органическая химия. В 12 т. / Под общ. ред. Д. Бартона и У.Д. Оллиса. — Т. 4; Черних В.П. Зіменковський Б.С., Гриценко І.С. Органічна хімія / За заг. ред. В.П. Черних. — Х., 2008.
