ДІАЗОСПОЛУКИ — органічні речовини, які містять угруповання з двох атомів азоту, поєднане з вуглеводневим радикалом. Загальна формула RN2X; в ароматичних Д. Х — аніон кислоти або гідроксильна група, в аліфатичних Х відсутній, але внаслідок аналогії реакцій цих сполук з реакціями ароматичних Д. за ними збереглася назва аліфатичних Д.:
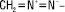
діазометан. Аліфатичні Д. нестійкі і дуже реакційноздатні сполуки, при нагріванні розкладаються з вибухом, реагують з водою, галогенами, галогеналканами тощо з виділенням азоту:

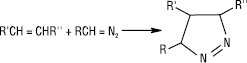
Легко конденсуються з ненасиченими сполуками з утворенням похідних піразолу або піразоліну:
Найбільше значення мають ароматичні Д.: Ar–N2–X. Якщо Х — залишок сильної мінеральної кислоти (Cl-, HSO4-, SO4-2, NO3- та ін.), Д. мають іонну будову
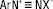
і називаються солями арендіазонію; якщо Х — залишок слабкої мінеральної кислоти (CN–, HSO3–, SН–, ОН– та ін.), то Д. мають ковалентну будову — ArN = N — X. Діазосполуки з формулою Ar–N=N–O–M+, де М — метал, називають діазотатами. Назви ароматичних Д. утворюють додаванням до назви відповідного вуглеводню суфікса —діазо із зазначенням кислотного залишку — С6Н5–N=N–CN — бензолдіазоціанід; у випадку солей діазонію — суфікса —діазоній та аніона кислоти — 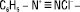 — бензолдіазонійхлорид.
— бензолдіазонійхлорид.
Залежно від рН середовища Д. можуть існувати у вигляді солей діазонію (І), власне діазосполук (ІІ) або діазотатів (ІІІ):
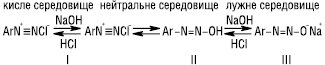
Солі діазонію (І) утворюються в дуже кислому розчині; нестійкі діазогідрати (ІІ) існують у середовищах, близьких до нейтральних; відносно стійкі діазотати (ІІІ) — в дуже лужному середовищі. Водні розчини солей арендіазонію одержують реакцією діазотування первинних ароматичних амінів азотистою (нітритною) кислотою:
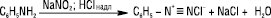
У кристалічному вигляді солі арендіазонію утворюються при дії на первинні ароматичні аміни ефірів азотистої кислоти в етанолі за наявності мінеральної кислоти:
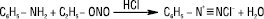
За фізичними властивостями солі арендіазонію нестійкі безбарвні кристалічні речовини; у кристалічному стані легко розкладаються, вибухонебезпечні при ударі, розчинні у воді. У розчинах розкладаються повільно при низьких температурах і значно швидше при нагріванні. Реакції за участю солей діазонію розділяють на дві групи: реакції з виділенням та без виділення азоту. Реакції з виділенням азоту дозволяють ввести в ароматичне ядро такі замісники, як F, Cl, Br, I, CN, NO2, що має велике значення для синтезу різноманітних ароматичних сполук, напр.:
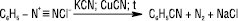 .
.
До реакцій без виділення азоту належать реакції азосполучення з ароматичними амінами, фенолами та сполуками, які містять активні метиленові групи; утворення діазоаміносполук при взаємодії з амінами, не здатними до азосполучення (ArN2X + Ar’NH2 → Ar–N=N–NH–Ar’). При нагріванні водних кислих розчинів Д. утворюються відповідні гідроксисполуки; нагрівання зі спиртами може проходити у двох напрямках — з введенням алкоксигрупи:
ArN2X + СH3ОН → ArОСН3 + НХ + N2,
або із заміщенням діазогрупи на водень:
ArN2X + С2H5ОН → ArН + CH3CHO + НХ + N2
за наявності лугів та відновників відбувається друга реакція.
Ароматичні Д. використовуються у виробництві азобарвників, проміжних продуктів у синтезі фармацевтичних препаратів.
Химическая энциклопедия. — В 5 т. — Т. 1 — М., 1990; Черных В.П., Зименковский Б.С., Гриценко И.С. Органическая химия / Под общ. ред. В.П. Черных. — 2-е изд. — Х., 2007.
