ЕТИЛЕНОКСИД (оксиран, 1,2-епоксіетан, окис етилену) — безбарвний газ з ефірним запахом; мол. м. 44,05.
 Основний промисловий метод одержання Е. є окиснення етилену киснем повітря над срібним каталізатором при температурі 300–400 °С, або дегідрохлоруванням етиленхлоргідрину, дією лугів на β-хлоретилацетат при температурі 100 °С, окисненням етилену органічними надкислотами (реакція Прилєжаєва). Тпл — 112,5 °С, Tкип — 10,7 °С; d420 0,8697; nD7 1,3597. Добрерозчинний у воді, етанолі, вуглеводнях та інших органічних розчинниках. При нагріванні до 300 °С стійкий, вище 400 °С в суміші з N2 ізомеризується в ацетальдегід. Е. — горючий, вибухонебезпечний та токсичний; подразнює шкіру та слизові оболонки. ГДК у повітрі — 1 мг/м3. При дії на Е. електрофільних і нуклеофільних реагентів відбувається приєднання молекули реагенту за місцем розриву зв’язку С–О циклу. Особливо легко ці реакції проходять за умов кислотного каталізу:
Основний промисловий метод одержання Е. є окиснення етилену киснем повітря над срібним каталізатором при температурі 300–400 °С, або дегідрохлоруванням етиленхлоргідрину, дією лугів на β-хлоретилацетат при температурі 100 °С, окисненням етилену органічними надкислотами (реакція Прилєжаєва). Тпл — 112,5 °С, Tкип — 10,7 °С; d420 0,8697; nD7 1,3597. Добрерозчинний у воді, етанолі, вуглеводнях та інших органічних розчинниках. При нагріванні до 300 °С стійкий, вище 400 °С в суміші з N2 ізомеризується в ацетальдегід. Е. — горючий, вибухонебезпечний та токсичний; подразнює шкіру та слизові оболонки. ГДК у повітрі — 1 мг/м3. При дії на Е. електрофільних і нуклеофільних реагентів відбувається приєднання молекули реагенту за місцем розриву зв’язку С–О циклу. Особливо легко ці реакції проходять за умов кислотного каталізу:
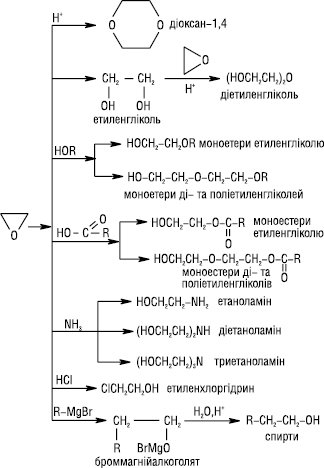
При окисненні Е. О2 у водному розчині AgNO3 утворюється гліколева кислота; при відновленні на Ni-кат. при 30 °С — етанол. У присутності сильних основ Е. полімеризується з утворенням поліетиленоксиду (поліетиленгліколю):
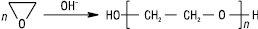 .
.
Поліетиленоксид застосовують у фармації як розчинник лікарських речовин, основу для мазей та супозиторіїв та як зв’язувальну речовину у виробництві таблеток.
Е. застосовують у виробництві етиленгліколів, галогенгідринів, етаноламінів, діоксану, фенілетанолу, поліетиленгліколів, неіоногенних ПАР, у медицині для стерилізації медичних інструментів, одноразових шприців.
Общая органическая химия. В 12 т. / Под общ. ред. Д. Бартона и У.Д. Оллиса. Т. 2. Кислородсодержащие соединения / Под ред. Дж.Ф. Стюарта. — М., 1982; Робертс Дж., Касерио М. Основы органической химии. — М., 1968. — Ч. 1; Черных В.П., Зименковский Б.С., Гриценко И.С. Органическая химия / Под общ. ред. В.П. Черных. — 2-е изд. — Х., 2007.
