ТРАНСПОРТНІ РНК (тРНК) — один із видів РНК-клітин, які становлять 10–15% (усієї клітинної РНК) і локалізовані в основному в гіалоплазмі та мітохондріях клітини. Це найбільш низькомолекулярні РНК, які містять від 75 до 93 нуклеотидів. Їх мол. м. становить 24–31∙103 кДа, константа седиментації — 4S (S — одиниця Сведберга). Основна функція тРНК полягає в тому, що вона за участю ферменту аміноацил-тРНК-синтетази з’єднується зі специфічною амінокислотою й транспортує її до місця біосинтезу білка — рибосом. На рибосомах тРНК впізнається і зв’язується зі своїм триплетом (кодоном) на мРНК, після чого амінокислота включається в поліпептид, що синтезується на мРНК. Таким чином, тРНК служить своєрідним перекладачем, або адаптором, який перекладає послідовність нуклеотидів із мРНК у послідовність амінокислотних залишків білкової молекули. Гіпотеза про адапторну роль тРНК, яка згодом стала доведеним фактом, належить Ф. Кріку. Проведені дослідження показали, що тРНК мають високу специфічність і кожна α,L-амінокислота має свою тРНК. Існує понад 60 видів тРНК, оскільки деякі α,L-амінокислоти транспортуються не однією, а декількома тРНК. Першою вивченою тРНК була аланінова тРНК, повна нуклеотидна послідовність якої була розшифрована Р. Холлі у 1965 р. Значний внесок у вивчення первинної структури тРНК зробили російський вчений О.О. Баєв і його колеги, які визначили послідовність нуклеотидів у валіновій тРНК. Нині вже вивчено первинну структуру понад 70 різних тРНК, які мають і спільні ознаки. Так, крім головних нуклеотидів (А, Г, Ц та У), кожна молекула тРНК містить нуклеотиди з мінорними основами (у середньому 10–12 основ на молекулу). Серед них метильовані похідні головних основ, які утворюються шляхом ферментативної модифікації тРНК-попередника, а також псевдоуридин, в якому рибоза приєднана до урацилу не через N-1, а через С-5 — дигідроуридин і риботимідин (містить тимін). Мінорні основи підвищують стійкість тРНК до дії рибонуклеаз цитоплазми і підтримують певну третинну структуру молекули, оскільки не беруть участі в утворенні комплементарних пар, а також перешкоджають спіралізації певних ділянок у полінуклеотидній послідовності тРНК. Крім того, деякі мінорні основи мають важливе значення для розпізнавання ферментом аміноацил-тРНК-синтетазою тієї транспортної РНК, яка взаємодіє з певною амінокислотою під час її активування. Вторинна структура у всіх тРНК подібна і має вигляд листка конюшини з кількома петлеподібними утвореннями, які відіграють певну роль у забезпеченні її біологічних функцій (рисунок).
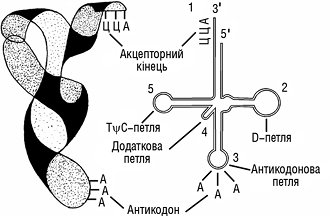
Рисунок. Вторинна (праворуч) та третинна (ліворуч) структури тРНК
Акцепторний 3′-кінець усіх молекул містить термінальну послідовність нуклеотидів ЦЦА, до якої через 3′-гідроксильну групу рибози аденозину приєднується активована амінокислота. Антикодонова петля (містить антикодон — ділянку з 3 специфічних нуклеотидів) розпізнає нуклеотидний триплет або кодон у мРНК і забезпечує специфічну взаємодію тРНК з мРНК. D-петля (дигідроуридилова петля) містить 1-4-дигідроуридилові залишки і забезпечує приєднання тРНК до ферменту. Псевдоуридилова петля (ТψС-петля) в усіх молекулах містить обов’язково залишок псевдоуридилової кислоти. Вважають, що ця петля відповідальна за приєднання тРНК до рибосоми. Додаткова петля має різну кількість нуклеотидів у різних тРНК. Рентгеноструктурні дослідження показали, що молекули тРНК утворюють більш компактні просторові конформації — третинні структури L-подібної форми (див. рисунок). Отже, тРНК забезпечують заданий порядок розташування α-амінокислот у процесі біосинтезу специфічного білка.
Губський Ю.І. Біологічна хімія. — К.–Тернопіль, 2000; Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека: В 2 т. — М., 1993; Страйер Л. Биохимия: В 3 т. — М., 1985. — Т. 3.
