НІТРОСПОЛУКИ — похідні вуглеводнів, які містять одну або кілька нітрогруп –NO2.
Нітрогрупа має плоску (планарну будову); атоми Нітрогену та Оксигену знаходяться в стані sp2-гібридизації. Електронна будова може бути представлена у вигляді двох граничних структур, в яких один з атомів Оксигену утворює з атомом Нітрогену подвійний, а другий — семіполярний зв’язок.
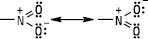
Залежно від природи вуглеводневого радикалу, з яким зв’язана нітрогрупа, розрізняють аліфатичні та ароматичні Н. За розміщенням нітрогрупи у вуглецевому ланцюгу Н. підрозділяють на первинні, вторинні й третинні. Назви Н. утворюють додаванням префікса нітро- до назви відповідного вуглеводню із зазначенням положення нітрогрупи у вуглецевому ланцюгу: CH3CH(NO2)CH2CH3 — 2-нітробутан, C6H5NO2 — нітробензен, C6H5CH2CH2NO2 — 1-нітро-2-фенілметан. Аліфатичні Н. — безбарвні рідини, які мають приємний запах і переганяються без розкладання, мало розчиняються у воді, токсичні, не викликають корозії металів, їх водні розчини мають нейтральну реакцію, Tкип вища, ніж у спиртів або карбонільних сполук. Ароматичні мононітросполуки — висококиплячі рідини або тверді низькоплавкі речовини, безбарвні або світло-жовтого кольору, важчі за воду і в ній не розчиняються, мають запах гіркого мигдалю. Н., які містять рухливі атоми Гідрогену біля атома Карбону, є таутомерними сполуками (нітро-ацинітротаутометрія):
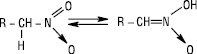
У лужному середовищі вони утворюють солі нітронових кислот:
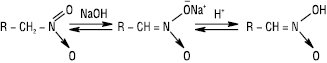
Із солей первинних нітроалканів у водних розчинах на холоді при дії мінеральних кислот можуть утворюватися альдегіди, а із солей вторинних нітроалканів — кетони. Натрієві солі нітронових кислот, на відміну від самих нітроалканів, легко взаємодіють з галогенами (Cl2, Br2, I2), утворюючи галогенопохідні з атомом галогену і нітрогрупою біля одного атома карбону. Із солей вторинних Н. утворюються моногалогенопохідні, із натрієвих солей первинних Н. (з надлишком галогену) — дигалогенопохідні. Реакція використовується як якісна. Характерна реакційна здатність Н. зумовлена як схильністю нітрогрупи до різних перетворень, так і її впливом на інші реакційні центри в молекулі. Нітрогрупу в Н. можна відновити до нітрозо-, гідроксил аміно- або аміногрупи; нітрогрупа може відщеплюватися у вигляді нітрит-іона. Первинні нітроалкани у слабколужному середовищі вступають у реакцію конденсації з альдегідами і кетонами, утворюючи нітроалканоли. Реакція відбувається за типом альдольної конденсації й завершується утворенням ненасичених Н.:
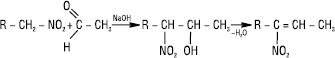
В аналітичній практиці використовується різне відношення первинних, вторинних і третинних нітроалканів до нітритної кислоти. Первинні Н. утворюють безбарвні нітролові кислоти, при розчиненні яких у лугах утворюються забарвлені в яскраво-червоний колір солі.
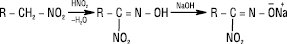
Вторинні Н. утворюють псевдонітроли — нейтральні сполуки, забарвлені в синій колір:
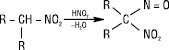
Третинні Н. з HNO2 не взаємодіють. Первинні й вторинні Н. при нагріванні з 85% H2SO4 підлягають гідролізу з утворенням карбонових кислот і солі гідроксиламіну (промисловий спосіб добування гідроксиламіну і деяких карбонових кислот):

Аліфатичні та ароматичні Н. легко відновлюються воднем у момент виділення або при дії LiAlH4 і NaBH4 у кислому середовищі з утворенням амінів:

Відновлення ароматичних Н. може відбуватися у кислому і лужному середовищі або електрохімічним шляхом. Як каталізатори використовують залізні ошурки, Sn і Zn, при каталітичному гідруванні — за наявності Ni-Ренея, Pd/C або Pd/PbCO3. В ароматичних Н. акцепторний вплив NO2-групи на бензенове кільце різко підвищує реакційну здатність по відношенню до нуклеофільних реагентів та ускладнює реакції з електрофілами. Нітробензен нітрується і сульфується, не вступає в реакцію алкілування за Фріделем — Крафтсом, легко вступає в реакції нуклеофільного заміщення, з твердим КОН утворює суміші о— і п-нітрофенолятів. Аліфатичні Н. добувають шляхом прямого нітрування алканів при підвищеній температурі в рідкій або газовій фазі розведеною нітратною кислотою або оксидами нітрогену, або алкілуванням нітриту аргентуму галогеналканами. Ароматичні Н. отримують прямим нітруванням аренів та їх похідних нітратною кислотою або нітруючою сумішшю (HNO3 + H2SO4), а в деяких випадках — окисненням нітрозо-, діазогруп, ариламінів дією H2SO5 або Н2О2.
За характером дії на живий організм Н. умовно поділяють на токсичні й лікарські речовини. Токсичні речовини: інсектициди (естери фосфорної кислоти), фуміганти (хлорпікрин), фунгіциди, гербіциди. Нітробензен здатний окиснювати гемоглобін у метгемоглобін; наркотичну дію виявляють нітрометан, 2-нітроетан, 1-нітропропан; 1,2,4-тринітробензен — сильно виражену алергічну дію. Похідні нітрофурану використовуються як антибактеріальні препарати (нітрофурал, фуразолідон, нітрофурантоїн та ін.), серцево-судинні (нітрогліцерин, пентаеритрилу тетранітрат, ізосорбіду динітрат), антикоагулянти (нітрофарин), антихолінестеразні (фосфакол, армін), антигельмінтні (похідні фенілсаліциланіліду), антипротозойні (тинідазол, метронідазол), антибіотики (хлорамфенікол, п-нітробензилпеніцилін та ін.).
Н. беруть участь у біохімічних процесах, впливають на реакції окиснення-відновлення і окиснювального фосфорилювання. В організмі Н. відновлюються білком фередоксином і флавіновими коферментами. У природі зустрічається обмежена кількість похідних Н., серед яких є антибіотики і канцерогенні речовини. Хлорамфенікол — антибіотик широкого спектра дії, що містить ароматичну нітрогрупу, виділений у кристалічному вигляді із культур Streptomyces venezuelae; 2-нітроімідазол (Азоміцин), виділений із Nocardia mesenterica, виявляє активність проти найпростіших одноклітинних організмів; аристохолові кислоти, виділені з рослин родини Aristocholiaceae, виявляють слабку протипухлинну і бактеріостатичну активність; 3-нітропропіонова кислота — кислотний компонент глікозиду гіптагену, виділеного із кореня яванського дерева Miptaga madablota, міститься в коренях Viola odorata, у грибах Aspergillus flavus, Penicillium atrovenetum та Aspengillus oryzae, у рослині Indigofena endecaphylla (родина Fabaceae); 1-феніл-2-нітроетан, виділений з деревини і кори Aniba canella і Octotea pcetiosa (родина Lauraceae), входить до складу деяких етерних олій і має характерний запах. Аліфатичні Н. використовують як розчинники етерцелюлозних лаків, вінілових полімерів, для очищення мінеральних олій; ароматичні Н. (нітробензени, нітротолуени) — для добування аніліну, бензидину, синтезу барвників, інших ароматичних сполук, для отримання вибухових і духмяних речовин.
Машковский М.Д. Лекарственные средства. — В 2 т. — М., 2000; Химия нитро- и нитрозогрупп / Под ред. Г. Фойера. — М., 1973. — Т. 2; Черных В.П., Зименковский Б.С., Гриценко И.С. Органическая химия / Под общ. ред. В.П. Черных. — 2 изд. — Х., 2007.
