РОЗЧИНИ ВИСОКОМОЛЕКУЛЯРНИХ СПОЛУК — термодинамічно стійкі гомогенні зворотні системи, які утворюються спонтанно при змішуванні полімерів і низькомолекулярних рідин. Але рівновага в Р.в.с. настає дуже повільно. Завдяки великій мол. м. молекули ВМС у розчинах за розмірами відповідають розмірам частинок високодисперсних систем (1–100 нм, частіше 40–80 нм), тому властивості Р.в.с. схожі на властивості колоїдних розчинів: мала швидкість дифузії макромолекул, здатність до діалізу, ультрафільтрації та розсіяння світла, утворення драглів аналогічне утворенню гелів (див. Гелі, Драглі). У зв’язку з цим розчини полімерів тривалий час помилково вважали дисперсними системами. Полімери розчиняються не у всіх розчинниках, тому вони можуть утворювати і дисперсні системи залежно від розчинника (див. Дисперсні системи). Особливим видом водних дисперсних систем є латекс — стабілізований золь полімеру типу олія/вода, який утворюється спонтанно за наявності емульгаторів.
Основні властивості Р.в.с. Механізм розчинення полімерів відрізняється від механізму розчинення низькомолекулярних речовин. При розчиненні останніх їх частинки дифундують в об’єм розчинника. У разі розчинення полімерів полімер виконує роль розчинника, а низькомолекулярна рідина — розчиненої речовини. Тобто відбувається дифузія молекул розчинника в об’єм полімеру. У початковий період молекули розчинника проникають у «порожнини» між макроланцюгами полімеру. При цьому відбувається зменшення загального об’єму системи. Це явище називають контракцією, яка супроводжується виділенням теплоти сольватації та в більшості випадків підпорядковується емпіричному рівнянню:
V = am(b + m), (1)
де v — контракція; m — маса рідини, поглиненої 1 г полімеру; a, b — сталі величини. Далі міжмолекулярні зв’язки в полімері послаблюються, і молекули розчинника все більше проникають у глибину полімеру. Об’єм його збільшується, а загальний об’єм системи залишається сталим. Однобічний процес проникнення молекул розчинника у фазу полімеру називається набуханням. Залежно від будови макроланцюга і характеру взаємодії макромолекул між собою і молекулами розчинника розрізняють обмежене і необмежене набухання. Необмежене набухання — це набухання, яке спонтанно переходить у розчинення, при якому утворюється однофазна гомогенна система. Обмеженим набуханням називається процес взаємодії полімеру з низькомолекулярною рідиною, обмежений стадією набухання. Спонтанне розчинення полімеру не відбувається, тобто його ланцюги повністю не відділяються один від одного. При цьому утворюються дві співіснуючі фази. Одна фаза є розчином низькомолекулярної рідини в полімері, а друга — чистою низькомолекулярною рідиною. Ці фази розділені видимою поверхнею поділу і перебувають у рівновазі. Якщо в полімері є просторова сітка, утворена хімічними зв’язками, то ланцюги макромолекул ні за яких температур не можуть бути розділені. Отже, просторові полімери принципово нерозчинні, однак вони можуть набухати, утворюючи драглі або гелі. Процес набухання кількісно характеризується ступенем і швидкістю набухання. Ступінь набухання (a) виражається кількістю рідини, поглиненої одиницею маси або об’єму полімеру. Він може бути визначений ваговим або об’ємним методом. Ваговий метод полягає у зважуванні зразка до і після набухання. Ступінь набухання розраховується за формулою:
α = (m–m0)/m0, (2)
де m0 — маса вихідного полімеру; m — маса полімеру, який набух. Об’ємний метод визначення ступеня набухання ґрунтується на вимірюванні об’єму полімеру до і після набухання:
α = (V–V0)/V0, (3)
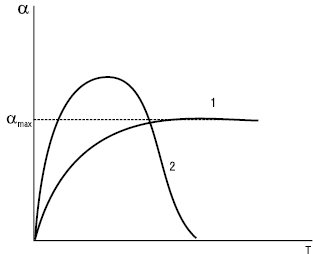
Рисунок
де V0 — об’єм вихідного полімеру; V — об’єм полімеру, який набух. Ступінь набухання змінюється з часом. На рисунку зображені кінетичні криві α = f(t) для обмеженого (1) і необмеженого набухання (2). При обмеженому набуханні α досягає граничного (максимального) значення αmax, при необмеженому крива проходить через максимум, після якого a падає до нуля внаслідок поступового розчинення полімеру. Швидкість набухання полімеру визначається швидкістю дифузії розчинника в нього, тому вона характеризується тими ж закономірностями, що й хімічна реакція 1-го порядку. Отже, константу швидкості набухання полімеру можна розрахувати за рівнянням:
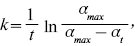 (4)
(4)
де αmax — граничний або максимальний ступінь набухання, αt — ступінь набухання до часу t.
При набуханні полімеру в умовах збереження сталого об’єму виникає тиск набухання, механізм виникнення якого подібний до механізму виникнення осмотичного тиску. Тиск набухання можна розрахувати за емпіричним рівнянням Позняка:
π = k· cn, (5)
де k і n — константи, які залежать від природи полімеру і розчинника; с — кількість сухої речовини в одиниці об’єму набухаючих драглів.
На здатність полімерів утворювати гомогенні системи з низькомолекулярними речовинами впливають різні фактори. Одним із них є природа полімеру і розчинника. ВМС з ізодіаметричними молекулами (напр. гемоглобін, глікоген) при розчиненні майже не набухають, а розчини цих речовин мають невисоку в’язкість навіть при дуже високих концентраціях і підпорядковуються рівнянням Пуазейля, Ейнштейна і Вант-Гоффа. ВМС із сильно асиметричними витягнутими молекулами (напр. желатин, целюлоза та її похідні, натуральний і синтетичні каучуки) при розчиненні дуже набухають і формують високов’язкі розчини, які не підлягають закономірностям, характерним для розчинів низькомолекулярних речовин. Набухання і розчинення аморфних лінійних полімерів залежать від ступеня полярності полімеру й розчинника. Якщо ланки ланцюгів і молекули розчинника близькі за полярністю, то настає набухання й розчинення полімеру. Якщо вони дуже відрізняються за полярністю, то набухання й розчинення не відбувається. Другим фактором, який впливає на розчинність полімерів, є гнучкість ланцюга полімеру. Полімери з гнучкими ланцюгами, як правило, необмежено набухають, тобто розчиняються. Більшу гнучкість мають ланцюги неполярних полімерів, які необмежено розчиняються в будь-якій неполярній рідині. Певний вплив на процеси набухання й розчинення виявляють мол. м. і кристалічність полімеру. Із збільшенням мол. м. полімеру у полімергомологічному ряду здатність до розчинення в одному й тому ж розчиннику знижується. Кристалічні полімери розчиняються значно гірше, ніж аморфні. Це пояснюється наявністю великої міжмолекулярної взаємодії, тому при кімнатній температурі кристалічні полімери, як правило, не розчиняються навіть у рідинах, схожих за полярністю.
Відповідно до другого закону термодинаміки розчинення ВМС відбувається спонтанно лише при зменшенні енергії Гіббса:
∆G = ∆H –T∆S < 0. (6)
Розчинення полімерів, які перебувають у високоеластичному стані, характеризується дуже невеликими як позитивними, так і негативними значеннями ∆Н і різким збільшенням ентропії (∆S >> 0). Отже, ∆G < 0. Тому полімери, які перебувають в еластичному стані, спонтанно і в більшості випадків необмежено змішуються з рідинами, що відповідають їм за полярністю. Розчиненню полімерів сприяє гнучкість ланцюга, оскільки ланки ланцюга можуть незалежно одна від одної обмінюватися місцями з молекулами розчинника, що й зумовлює великі додатні значення ентропії розчинення. Склоподібні полімери розчиняються у рідинах, близьких до них за полярністю, з виділенням теплоти (∆Н < 0). Проникнення низькомолекулярної рідини у фазу полімеру супроводжується зменшенням ентропії (∆S < 0). При |Т·∆S| < |∆Н| відбувається розчинення. При |Т·∆S| > |∆Н| спостерігається обмежене набухання.
На відміну від істинних та колоїдних розчинів, для яких осмотичний тиск визначають за рівнянням Вант-Гоффа:
π = (c/M)/RT, (7)
осмотичний тиск Р.в.с. розраховують за формулою:
π = cRT/M + bc2, (8)
де с, М — концентрація і мол. м. ВМС; b — другий віріальний коефіцієнт, який відображає флуктуацію конформаційних структур макромолекул. Сегменти гнучкої макромолекули у розчині поводять себе як декілька коротких молекул і відіграють роль окремих кінетичних елементів. При підвищенні концентрації зростає кількість сегментів, на які можна умовно розділити макромолекулу, тому осмотичний тиск Р.в.с. зростає значно більше, ніж вимагає закон Вант-Гоффа. Якщо розділити праву та ліву частини рівняння (8) на концентрацію, то одержимо вираз:
π/c = RT/M + bc. (9)
Величину π/c називають приведеним осмотичним тиском. Для ідеальних розчинів і більшості істинних та колоїдних розчинів значення π/c залишається сталим і не залежить від концентрації. Для Р.в.с. за рахунок різниці конформаційних форм макромолекул ВМС величина π/c змінюється залежно від концентрації ВМС. Визначення мол. м. за даними вимірювання осмотичного тиску розбавлених розчинів на підставі рівняння (9) широко застосовується для ВМС з мол. м. 1·104–2·105.
За дифузійними властивостями Р.в.с. наближаються до колоїдних систем внаслідок великого розміру макромолекул. Визначення коефіцієнта дифузії широко використовують для встановлення мол. м. ВМС, напр. білків. Р.в.с. характеризуються високою седиментаційною стійкістю, що зумовлено малою густиною розчиненої речовини. Тому для визначення мол. м. ВМС методом седиментації необхідно використовувати потужну ультрацентрифугу. Р.в.с. здатні розсіювати світло, хоч і менше, ніж колоїдні системи. Розсіювання світла зумовлене їх неоднорідністю, яка виникає внаслідок безперервних незначних відхилень концентрації, що викликають флуктуації показника заломлення від середнього значення. Одна з важливих особливостей розчинів полімерів полягає в тому, що їх в’язкість значно більша за в’язкість розчинів низькомолекулярних речовин. Навіть їх розбавлені розчини слаботекучі порівняно з чистим розчинником. В’язкість Р.в.с. залежить від концентрації розчину. Але ця залежність не підпорядковується рівнянню Ейнштейна, яке застосовується для розчинів низькомолекулярних речовин. Нелінійний характер зростання в’язкості розчинів полімерів при підвищенні концентрації зумовлений утворенням структурної сітки з макромолекул. Зі зменшенням довжини макромолекул вони стають більш гнучкими і чинять менший опір потоку. Штаудингер показав, що для розбавлених розчинів полімерів з жорсткими молекулами питома в’язкість розчину описується рівнянням:
ηпит = K⋅M⋅с, (10)
де K — константа для цього полімергомологічного ряду в даному розчиннику; M — мол. м. полімеру; c — масова концентрація розчину полімеру. При цьому:
ηпит = (η –η0)/ η0, (11)
де η0, η — в’язкість розчинника і розчину відповідно.
З рівняння (7) випливає, що приведена в’язкість (ηпр) дорівнює
ηпр =ηпит/с = K⋅M. (12)
Але для більшості розчинів полімерів приведена в’язкість лінійно зростає з підвищенням концентрації. Відрізок, що відтинається прямою на осі ηпр, називається характеристичною в’язкістю [η], яка є граничним значенням приведеної в’язкості розчину при концентрації, що наближається до нуля
[η] = lim ηпр (13)
с→0
Характеристична в’язкість залежить лише від природи полімеру і не залежить від його концентрації. Її залежність від природи полімеру описується узагальненим рівнянням Штаудингера. Його також називають рівнянням Марка — Куна — Хаувінка:
[η] = K⋅Mα, (14)
де M — мол. м. полімеру; K і α — коефіцієнти, сталі для даного гомологічного ряду полімеру і розчинника. Величина α характеризує форму макромолекул у розчині й пов’язана з гнучкістю їх ланцюгів. Значення α перебуває в межах 0,5–1,0. Для жорстких макромолекул α = 1. Узагальнене рівняння Штаудингера використовують для визначення мол. м. полімерів, які застосовують у медицині та фармації. Цей метод включено до ДФУ.
Р.в.с. знаходять широке застосування в медицині й фармації. Так, у медичній практиці їх використовують як плазмозамінники, кровозамінники (розчин полівінілового спирту, полівінілпіролідону). У фармації їх застосовують при виготовленні ЛП пролонгованої дії; у вигляді гелів (див. Гелі). Біополімери становлять основу всіх живих організмів і у вигляді розчинів беруть участь у всіх процесах життєдіяльності.
БМЭ. — М., 1985; БСЭ. — М., 1983; Воюцкий С.С. Курс коллоидной химии. — М., 1976; Краткая химическая энциклопедия. В 5 т. — М., 1965. — Т. 4; Полимеры в фармации / Под ред. А.И. Тенцовой, Н.Т. Алюшина. — М., 1985; Фізична і колоїдна хімія / В.І. Кабачний, Л.К. Осіпенко, Л.Д. Грицан та ін. — Х., 1999; Химическая энциклопедия: В 5 т. — М., 1988. — Т. 1.
